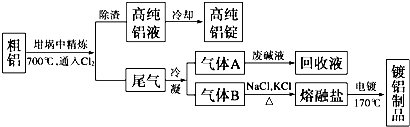
题目内容
19.下列关于化学反应中的能量变化的表述正确的是( )| A. | 加热才能发生的反应一定是吸热反应 | |
| B. | 断开化学键的过程会吸收能量 | |
| C. | 化学能不仅可以与热能相互转化,还可以与电能相互转化 | |
| D. | 燃烧可能为吸热反应 |
分析 A、吸热反应不一定需要加热热才发生,加热才能发生的反应不一定是吸热反应;
B、旧化学键的断裂需要吸收能量;
C、形成原电池时即将化学能转化成电能,形成电解池时将电能转化成化学能;
D、燃烧反应都是放热反应.
解答 解:A、吸热反应不一定需要加热热才发生,如氯化铵和十水合氢氧化钡的反应就是吸热的,加热才能发生的反应不一定是吸热反应,如铝热反应,故A错误;
B、断开化学键的过程会吸收能量,故B正确;
C、发生化学反应即可实现化学能不仅可以与热能相互转化,形成原电池时即将化学能转化成电能,形成电解池时将电能转化成化学能,所以化学能不仅可以与热能相互转化,还可以与电能相互转化,故C正确;
D、燃烧反应都是放热反应,不可能是吸热反应,故D错误.
故选BC.
点评 本题主要考查了化学反应中能量变化的原因以及能量转化形式,难度不大,需要强调的是反应是吸热反应还是放热反应与反应的条件无关.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
9.元素周期表可以划分为5个区,下列有关说法正确的是( )
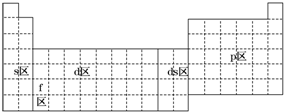

| A. | s区全部是金属元素 | |
| B. | p区全部是非金属元素 | |
| C. | d区内元素原子的价电子排布必为(n-1)d1~10ns2 | |
| D. | 除ds区外,以最后填入电子的轨道能级符号作为区的符号 |
10.下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是( )
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
①CO2与NaOH溶液
②NaHCO3溶液与盐酸
③Na与氧气
④C与O2
⑤AlCl3溶液与氨水
⑥Na2S与FeCl3溶液.
| A. | 除③外 | B. | 除①④⑥外 | C. | 除②③⑤外 | D. | 除②⑤外 |
7.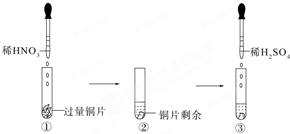 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )| A. | 铜片溶解,因铜与稀H2SO4反应生成SO2 | |
| B. | 铜片溶解,产生无色气体,该气体为H2 | |
| C. | 无明显现象,因稀H2SO4不与铜反应 | |
| D. | 铜片溶解,产生无色气体,该气体在试管口变为红棕色 |
14.下列反应的离子方程式正确的是( )
| A. | 铁跟氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| B. | 氨水跟盐酸反应:OH-+H+→H2O | |
| C. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+→CO2↑+H2O |
11.在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)?2C(g)+D(S),可以判断达到化学平衡状态的是( )
| A. | 体系压强不变 | |
| B. | 单位时间消耗n molA,同时生成2nmolC | |
| C. | 容器内气体密度不变 | |
| D. | A、B、C、D的反应速率之比为1:1:2:1 |
8.已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,并加水稀释到50mL,其中出现浑浊最快的是( )
| A. | 20℃,20mL、3mol/L的Na2S2O3溶液 | B. | 10℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 10℃,30mL、2mol/L的Na2S2O3溶液 | D. | 20℃,10mL、4mol/L的Na2S2O3溶液 |
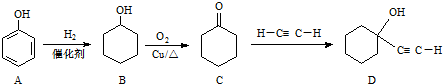
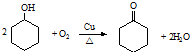 .
.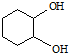 ,反应类型依次是c(选填序号).
,反应类型依次是c(选填序号).