题目内容
4.W、M、X、Y四种短周期元素在周期表中的位置如图1所示,其中只有M为金属元素.Z是第四周期元素,Z的3d轨道中有6个电子.请回答下列问题:
(1)Z基态原子的电子排布式为1s22s22p63s23p63d64s2{或[Ar]3d64s2},比较W与Y两种元素的第一电离能大小:F>S(用元素符号表示).
(2)写出X的氧化物与W的氢化物的水溶液反应的化学方程式:SiO2+4HF=SiF4↑+2H2O
(3)科学家研制出一种英文名为sulflower的新型分子C16Y8(结构如图2所示),它将成为潜在的储氢材料.C16Y8分子中π键与σ键的个数比为1:4,1molC16Y8最多能与8molH2发生加成反应.
(4)Z与Y形成的某种化合物的晶胞结构如图3所示,该化合物的化学式为FeS2.已知该晶胞边长为a cm,则该化合物的密度为$\frac{352}{{a}^{3}{N}_{A}}$g•cm-3(设NA为阿伏伽德罗常数的数值).
分析 W、M、X、Y四种短周期元素在周期表中的位置如图1所示,其中只有M为金属元素,根据元素在周期表中的位置知,M是Al、X是Si、Y是S、W是F元素;
Z是第四周期元素,Z的3d轨道中有6个电子,则Z为Fe元素;
(1)Z为26号元素Fe,其原子核外有26个电子,根据构造原理书写Z基态原子的电子排布式;
W是F元素、Y是S元素,同一周期元素,第一电离能随着原子序数增大而呈增大趋势,同一主族元素,第一电离能随着原子序数增大而减小;
(2)X是Si,X的氧化物是二氧化硅,W是F元素,其氢化物是HF,二氧化硅和HF反应生成四氟化硅和水;
(3)共价单键为σ键,共价双键中一个是σ键一个是π键;
碳碳双键能和氢气发生加成反应,且碳碳双键和氢气按1:1反应;
(4)Fe与S形成的某种化合物的晶胞结构如图3所示,该晶胞中Fe原子个数8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,S原子个数为8,据此计算该化合物的化学式;
该晶胞边长为a cm,体积为a3cm3,该化合物的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:W、M、X、Y四种短周期元素在周期表中的位置如图1所示,其中只有M为金属元素,根据元素在周期表中的位置知,M是Al、X是Si、Y是S、W是F元素;
Z是第四周期元素,Z的3d轨道中有6个电子,则Z为Fe元素;
(1)Z为26号元素Fe,其原子核外有26个电子,根据构造原理书写Z基态原子的电子排布式为1s22s22p63s23p63d64s2{或[Ar]3d64s2};
W是F元素、Y是S元素,同一周期元素,第一电离能随着原子序数增大而呈增大趋势,同一主族元素,第一电离能随着原子序数增大而减小,所以第一电离能S<Cl、Cl<F,则F>S;
故答案为:1s22s22p63s23p63d64s2{或[Ar]3d64s2};F>S;
(2)X是Si,X的氧化物是二氧化硅,W是F元素,其氢化物是HF,二氧化硅和HF反应生成四氟化硅和水,二者反应方程式为SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)共价单键为σ键,共价双键中一个是σ键一个是π键,该分子中σ键、π键个数分别是32、8,所以σ键、π键个数之比=32:8=4:1,所以π键与σ键的个数比为1:4;
碳碳双键能和氢气发生加成反应,且碳碳双键和氢气按1:1反应,该反应中含有8个碳碳双键,所以1molC16Y8最多能与8mol氢气发生加成反应,
故答案为:1:4;8;
(4)Fe与S形成的某种化合物的晶胞结构如图3所示,该晶胞中Fe原子个数8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,S原子个数为8,则该晶胞中Fe、S原子个数之比=4:8=1:2,其化学式为FeS2;
该晶胞边长为a cm,体积为a3cm3,该化合物的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{88}{{N}_{A}}×4}{{a}^{3}}$g•cm-3=$\frac{352}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:FeS2;$\frac{352}{{a}^{3}{N}_{A}}$.
点评 本题考查晶胞计算、原子核外电子排布、电离能等知识点,侧重考查学生计算及空间想象能力,这些都是高频考点,难点是(4)中密度计算,注意密度公式中$\frac{M}{{N}_{A}}$的含义,题目难度中等.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )| A. | 分子中不含有非极性键 | B. | 1mol该分子中含8mol二氧化氮 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、C02、H20 |
| A. | 工业上制取玻璃的工艺是应用了物质酸性的差异 | |
| B. | 家庭里可用淀粉检验加碘盐是否含有碘 | |
| C. | 铁是人体必需的微量元素,所以可以适当地吃点铁锈 | |
| D. | 王水是由浓盐酸和浓硝酸两种物质按3:1的体积比混合配制成的 |

| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |
| A. | 53.8% | B. | 58.3% | C. | 60.3% | D. | 70.0% |
| A. | 为防止富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 铬是人体必需的微量元素,但铬过量会危害人体健康,其中六价铬的毒性最大.人体内六价铬超标,可以服用维生素C缓解毒性,说明维生素C具有氧化性 | |
| C. | 去年冬天的雾霾天气严重影响了人们的正常出行和生活节奏.为改善空气质量,可以加高工厂的烟囱,使烟尘和废气远离地表 | |
| D. | 硅酸钠是最简单的硅酸盐,是制备硅胶和木材防火剂的原料 |

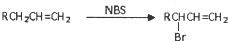
 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式 (其中之一).
(其中之一).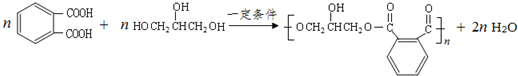 .
.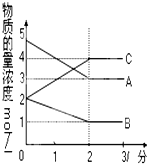 在恒容密闭容器中,某反应在不同反应时间各物质的量浓度的变化情况如图所示(各物质均为气体).请回答下列问题:
在恒容密闭容器中,某反应在不同反应时间各物质的量浓度的变化情况如图所示(各物质均为气体).请回答下列问题: .
. .
.