题目内容
11.已知在碱存在下,卤代烃与醇反应生成醚(R-O-R′):R-X+R′OH$\stackrel{KOH/高温}{→}$R-O-R′+HX,则BrCH2CH2CH2OH可发生的反应有:①氧化反应;②还原反应;③加成反应;④在强酸强碱条件下均可发生消去反应;⑤可发生聚合反应生成高分子化合物,其中正确的组合是( )
| A. | ①②③ | B. | ①④ | C. | ①④⑤ | D. | ②③④ |
分析 卤代烃与醇反应生成醚(R-O-R′):R-X+R′OH$\stackrel{KOH/高温}{→}$R-O-R′+HX,此反应为取代反应,另外卤代烃能在氢氧化钠的醇溶液中发生消去反应,在氢氧化钠的水溶液中发生取代反应,醇类能被氧化生成醛,消去反应生成烯烃,据此解答即可.
解答 解:BrCH2CH2CH2OH中含有2种官能团,分别为羟基和卤素原子,醇类能被氧化生成醛类,故①正确;
不能发生还原反应,故②错误,
不能发生加成反应,故③错误;
在氢氧化钠的醇溶液中可以发生消去反应生成烯烃,可以在浓硫酸作用下消去羟基生成烯烃,故④正确,
由于含有羟基,能与羧酸在一定条件下发生聚合反应生成高分子化合,故⑤正确,综上正确的是①④⑤,
故选C.
点评 本题主要考查的是醇类与卤代烃的性质,分别掌握卤代烃和醇类的官能团以及其性质是解决本题的关键,注意卤代烃在碱性条件下分别在醇中和水中发生反应的不同,难度不大.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 分子间作用力与化学键的键能大小相当 | |
| B. | 分子间作用力远强于化学键,是一种很强的作用 | |
| C. | 氢键主要影响物质的化学性质 | |
| D. | 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间存在的相互作用称为分子间作用力 |
6.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为互为同位素;R在元素周期表中的位置是第3周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
| X | Y | Z | M | R | Q | |
| 原子半 径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要 化合价 | -4, +4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
16.可用于区别苯酚、乙醇、氢氧化钠、硝酸银、硫氰化钾五种溶液的一种试剂是( )
| A. | FeCl3溶液 | B. | 石蕊试液 | C. | 浓溴水 | D. | FeCl2溶液 |
20.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜1万倍;N5可以做烈性炸药.下列叙述正确的是( )
| A. | 14C的质子数为14 | B. | N5N2互为同素异形体 | ||
| C. | 金刚石和纳米管互为同位素 | D. | C原子半径比N原子半径小 |
1.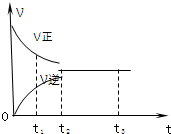 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应不再发生 | D. | t2-t3,各物质的浓度还在发生变化 |

 ; F
; F  ;
;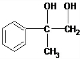 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;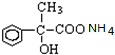 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.