题目内容
已知反应3A(g)+B(g) C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )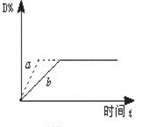
①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
| A.①② | B.①③ | C.②③ | D.③④ |
D
解析试题分析:分析题给图像知,曲线b变为曲线a,到达平衡的时间缩短,改变条件能加快反应速率;D的体积分数,条件改变平衡不移动。①增大B的浓度,反应速率加快,平衡向正反应移动,D的体积分数增大,错误;②升高反应温度,反应速率加快,平衡向逆反应移动,D的体积分数减小,错误;③缩小反应容器的体积相当于加压,反应速率加快,该反应为反应前后气体的物质的量不变的反应,平衡不移动,D的体积分数不变,正确;④加入催化剂,加快反应速率,不影响平衡移动,D的体积分数不变,正确;选D。
考点:考查外界条件对化学反应速率和化学平衡的影响规律、化学平衡图像。

 阅读快车系列答案
阅读快车系列答案某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成Z,反应2min后,测得参加反应的X2为0.6mol/L,用Y2变化表示的反应速率v(Y2)= 0.1mol/(L?min),生成的c(Z) =" 0.4" mol/L,则该反应方程式为
A.3X2+Y2 2X3Y 2X3Y | B.2X2+Y2 2X2Y 2X2Y |
C.X2+2 Y2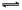 2XY2 2XY2 | D.X2+3Y2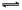 2XY3 2XY3 |
一定温度下,将1molA(g)和1molB(g)充入2 L密闭容器中发生反应,在t1时达到平衡:A(g)+B(g) xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件(温度、体积、催化剂或一种物质),测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件(温度、体积、催化剂或一种物质),测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
( ) 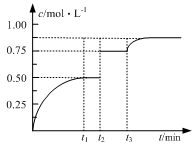
| A.反应方程式中x=1 |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量D |
| D.t1~t3间该反应的平衡常数均相同 |
下图是可逆反应X2 + 3Y2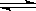 2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
| A.t1时,只有正方向反应 |
| B.t2时,反应到达限度 |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度不再发生变化 |
下列措施是为了降低化学反应速率的是
| A.食品放在冰箱中贮藏 |
| B.双氧水制氧气时加入少量二氧化锰 |
| C.试管中进行镁和水反应时,稍微加热 |
| D.铁粉代替铁钉与稀硫酸反应制取氢气 |
对于达到化学平衡状态的可逆反应:N2 + 3H2 2NH3 + Q,下列叙述中正确的
2NH3 + Q,下列叙述中正确的
| A.反应物和生成物的浓度相等 | B.反应物和生成物的浓度不再变化 |
| C.降低温度,平衡混合物中NH3的浓度减小 | D.增大压强,不利于氨的合成 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
| A.①③⑤ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
| A.K值不变,平衡可能移动 | B.K值变化,平衡一定移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |