题目内容
下图是可逆反应X2 + 3Y2 2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
| A.t1时,只有正方向反应 |
| B.t2时,反应到达限度 |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度不再发生变化 |
BD
解析试题分析:A选项,在任何的适合,可逆反应都有正反应方向也有逆反应方向。B选项t2说明该反应达到了平衡的状态,即达到了限度。所以B选项是正确的。C选项,是动态平衡所以C选项是错误的。D选项,当达到平衡后,各物质的浓度保持不变。所以答案选BD
考点:考查化学平衡状态的相关知识点

 阅读快车系列答案
阅读快车系列答案反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI ③2v正(H2)=v逆(HI) ④HI分子数不再改变 ⑤混合气体颜色不再改变 ⑥混合气体压强不再改变
| A.②④⑤⑥ | B.②③④⑤ | C.①③④⑤ | D.全部 |
对于300mL 1 mol·L-1盐酸与铁片的反应,采取下列措施:
①升高温度 ②改用100mL 3 mol·L-1盐酸
③再加300mL 1 mol·L-1盐酸 ④用等量铁粉代替铁片 ⑤改用100mL 98%的硫酸
其中能使反应速率加快的是
| A.①②④ | B.①③④ | C.①②③④ | D.①②③⑤ |
下列关于化学反应的速率和限度的说法不正确的是( )
| A.任何可逆反应都有一定的限度 |
| B.影响化学反应速率的条件有温度、催化剂、浓度等 |
| C.化学平衡状态指的是反应物和生成物浓度相等时的状态 |
| D.决定反应速率的主要因素是反应物的性质 |
已知反应3A(g)+B(g) C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )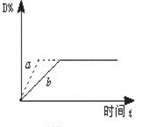
①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
| A.①② | B.①③ | C.②③ | D.③④ |
下列叙述不正确的是
| A.铁生锈、白磷燃烧均为自发放热过程 |
| B.冰融化过程其熵值增大 |
| C.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| D.同一物质固态时熵值最小 |
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化,2SO2(g)+O2(g) 2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
| A.达到平衡时,SO2的浓度与SO3的浓度相等 |
B.相同状况下,反应2SO3(g)  2SO2(g)+O2(g)是一个吸热反应 2SO2(g)+O2(g)是一个吸热反应 |
| C.为了提高SO2转化率,可适当提高O2浓度 |
| D.升高温度,放热反应的速率增大,吸热反应的速率也增大 |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |
 2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( )