题目内容
某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成Z,反应2min后,测得参加反应的X2为0.6mol/L,用Y2变化表示的反应速率v(Y2)= 0.1mol/(L?min),生成的c(Z) =" 0.4" mol/L,则该反应方程式为
A.3X2+Y2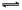 2X3Y 2X3Y | B.2X2+Y2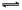 2X2Y 2X2Y |
C.X2+2 Y2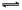 2XY2 2XY2 | D.X2+3Y2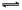 2XY3 2XY3 |
A
解析试题分析:△C(Y2)=v(Y2)×△t=0.1mol/(L?min)×2min=0.2mol/L,则X2、Y2、Z变化的物质的量浓度之比为0.6:0.2:0.4=3:1:2,则化学方程式为:3X2+Y2 2Z,再根据质量守恒,可得3X2+Y2
2Z,再根据质量守恒,可得3X2+Y2 2X3Y,故C项正确。
2X3Y,故C项正确。
考点:本题考查化学方程式、化学与反应速率的应用。

练习册系列答案
相关题目
反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI ③2v正(H2)=v逆(HI) ④HI分子数不再改变 ⑤混合气体颜色不再改变 ⑥混合气体压强不再改变
| A.②④⑤⑥ | B.②③④⑤ | C.①③④⑤ | D.全部 |
下列过程中,需要增大化学反应速率的是( )
| A.钢铁腐蚀 | B.食物腐败 | C.塑料老化 | D.工业合成氨 |
对于可逆反应N2(g)+3H2(g)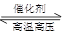 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.υ(H2)=0.3mol/(L·min) | B.υ(N2)=0.2mol/(L·min) |
| C.υ(NH3)=0.25mol/(L·min) | D.υ(H2)=0.4mol/(L·min) |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列说法正确的是 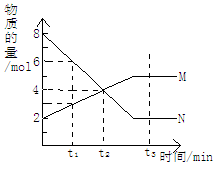
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
 2AB(g)达到反应限度的标志是
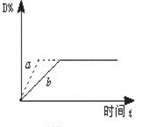
2AB(g)达到反应限度的标志是 C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )