题目内容
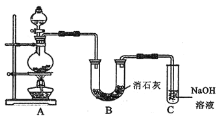
【题目】某化学学习小组设计如图实验装置(夹持和加热装置略去)制备Cl2,并探究氯气的相关性质。

回答下列问题:
⑴ 装置中a玻璃仪器的名称为_____________;整套装置装配完毕后,首先进行的操作是______________,再添加试剂。
⑵ 若A装置中的固体药品为MnO2,其化学方程式为_______________________。若A装置中的固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为_________mol(结果保留两位小数)。
⑶ 装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是_________、_____________。
⑷ 设计装置D、E的目的是比较氯、溴、碘的非金属性。但有同学认为该设计不够严密,他的理由可能是_____________。
⑸ 甲同学提出,装置F中改用过量的Na2SO3溶液,乙同学认为此法不可行。请用离子方程式解释乙认为不可行的原因:_____________。
【答案】分液漏斗 检查气密性 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1.67 无水氯化钙 干燥的有色布条 不能排除氯气对溴、碘的非金属性强弱实验的干扰 SO32-+Cl2+H2O=SO42-+2Cl-+2H+、 SO32-+2H+===SO2↑+H2O
MnCl2+Cl2↑+2H2O 1.67 无水氯化钙 干燥的有色布条 不能排除氯气对溴、碘的非金属性强弱实验的干扰 SO32-+Cl2+H2O=SO42-+2Cl-+2H+、 SO32-+2H+===SO2↑+H2O
【解析】
(1)仪器a为分液漏斗,该实验目的是制备Cl2,因此装配完毕后,应检验装置的气密性;
(2)MnO2与浓盐酸反应制备Cl2,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;如果药品是KClO3,发生反应方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,每生成1molCl2,转移电子物质的量为1mol×5/3≈1.67mol;
MnCl2+Cl2↑+2H2O;如果药品是KClO3,发生反应方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,每生成1molCl2,转移电子物质的量为1mol×5/3≈1.67mol;
(3)验证Cl2是否具有漂白性,I处为湿润的有色布条,II处作用为干燥氯气,根据仪器特点,盛放的药品为无水氯化钙或者为P2O5,Ⅲ处应与I处作对照实验,因此Ⅲ处应为干燥有色布条;
(4)比较氯、溴、碘的非金属性,利用置换反应,根据装置图,Cl2可能与KI溶液反应,对比较溴和碘非金属性产生干扰,因此缺陷是不能排除氯气对溴、碘的非金属性强弱实验的干扰;
(5)Cl2具有强氧化性,能把Na2SO3氧化成Na2SO4,离子反应方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+,所加Na2SO3为过量,因此2H++SO32-=SO2↑+H2O,SO2有毒,对环境有污染。

 名校课堂系列答案
名校课堂系列答案【题目】根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式 | 电离常数 |
HClO | K = 3×10-8 |
H2CO3 | K1 = 4×10-7 K2 = 6×10-11 |
A. 向NaClO溶液中通少量CO2:CO2+NaClO+H2O===NaHCO3+HClO
B. 向NaClO溶液中通过量CO2:CO2+2NaClO+H2O===Na2CO3+2HClO
C. 向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O===2Cl-+2HClO+CO2↑
D. 向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2===Cl-+ClO-+2CO2↑+H2O