题目内容
【题目】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1)![]() 键和
键和![]() 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________;水溶液中存在H3O+离子,写出该微粒的结构式________(标出配位键)。
(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:
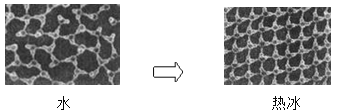
使水结成“热冰”采用“弱电场”的条件,说明水分子是______分子。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用力类型完全相同的是______。
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式__________;该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式____________________。
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因______________________;试从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是___________________________。
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为________g/cm3(计算结果保留两位有效数字)
【答案】2个σ键 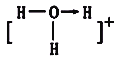 极性 A 2H2O++SO2=4H++SO42- H2O++H2O=H3O++-OH 水分解需要破坏分子内部的极性键,水的气化只需破坏分子间的范德华力与氢键即可,而极性键远比分子间的范德华了与氢键强得多 在冰的晶体中,每个水分子周围有4个紧邻的水分子,使冰晶体中水分子的空间利用率不高,分子之间的空隙较大,密度较小 0.92
极性 A 2H2O++SO2=4H++SO42- H2O++H2O=H3O++-OH 水分解需要破坏分子内部的极性键,水的气化只需破坏分子间的范德华力与氢键即可,而极性键远比分子间的范德华了与氢键强得多 在冰的晶体中,每个水分子周围有4个紧邻的水分子,使冰晶体中水分子的空间利用率不高,分子之间的空隙较大,密度较小 0.92
【解析】
(1)根据H、O原子结构及形成的化学键判断;根据O原子具有孤对电子,而H+具有空轨道分析H3O+的形成;
(2)①极性分子能在磁场作用下凝结;然后根据题目给出物质判断是否为极性分子分析;
②由水分子释放出电子时产生的一种阳离子可以表示成H2O+,根据题中信息判断生成物,进而书写反应的离子方程式;
(3)根据水的晶体类型、熔化与分解时破坏的作用力类型的不同及强弱大小分析;并从分子排列的是否有序、分子间距离大小分析密度的变化;
(4)根据ρ=![]() 进行计算。
进行计算。
(1)在H2O中O原子与2个H原子分别形成1对共用电子对,共价单键都是σ键,因此H2O中含有2个σ键;在H2O的O原子上具有孤对电子,而H+只有原子核,所以当H+与H2O接近时,H2O中O原子与H+形成配位键,从而结合形成H3O+,该微粒的结构式为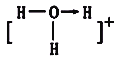 ;
;
(2)①水在磁场作用下发生凝结,说明水分子为极性分子;
在给出的四种物质中,食盐是离子晶体,金刚石是原子晶体,氨、干冰为分子晶体,由分子构成,其中干冰是固体CO2,CO2分子是非极性分子,氨分子是极性分子,因此只有固态氨熔化时,所克服的微粒间的作用与热冰相同,合理选项是A;
②由水分子释放出电子时产生的一种阳离子,可以表示成H2O+,由于H2O+氧化性很强,可以氧化具有强的还原性SO2生成硫酸,2H2O++SO2=4H++SO42-,根据信息:该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,可知该过程的离子方程式为H2O++H2O=H3O++-OH;
(3)水是由分子构成的分子晶体,熔化、气化破坏的是分子间作用力和氢键,而水分解破坏的是极性共价键,极性共价键远比分子间作用力和氢键强得多,所以水的沸点比水分解的温度低很多;
在液体水中水分子排列无序,相对来说分子间的距离较小,单位体积内分子数较多,液态水的密度较大,而在固态水——冰的晶体中,每个水分子周围有4个紧邻的水分子,使冰晶体中水分子的空间利用率不高,分子之间的空隙较大,从而导致冰的密度比液态水的密度小;
(4)根据晶体密度计算公式可得ρ= =0.92g/cm3。
=0.92g/cm3。