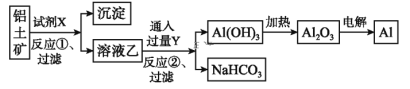
题目内容
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是( )
CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是( )
A. △H2>△H3B. △H1+△H3 =△H2
C. △H1<△H3D. △H1+△H2>△H3
【答案】C
【解析】
① 胆矾溶于水时,溶液温度降低,反应为CuSO45H2O(s)=Cu2+(aq)+SO42 (aq)+5H2O(l) △H1>0;
② 硫酸铜溶于水,溶液温度升高,该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42 (aq)△H2<0;
③ 已知CuSO45H2O(s)=CuSO4(s)+5H2O(l)△H3;
依据盖斯定律①②得到③:△H3=△H1△H2,由于△H2<0,△H1>0,则△H3>0,
A.分析可知△H3>0,而△H2<0,则△H3>△H2,故A错误;
B. △H3=△H1△H2,则△H1=△H3+△H2,故B错误;
C.上述分析可知:△H2<0,△H3>0,△H3=△H1△H2则△H2=△H1△H3<0,即△H1<△H3,故C正确;
D.△H2<0,△H1>0,且△H1=△H3+△H2,则△H3>△H1+△H2,故D错误;
故选B.

【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和②B. ②和④C. ③和④D. ①和③