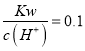题目内容
【题目】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A. 5 B. 4 C. 3 D. 2
【答案】A
【解析】
Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,S元素的化合价由-![]() 价变为+6价,NaClO被还原成NaCl,Cl元素的化合价由+1价变为-1价,根据得失电子守恒计算x值。
价变为+6价,NaClO被还原成NaCl,Cl元素的化合价由+1价变为-1价,根据得失电子守恒计算x值。
因为在NaClO中Cl的化合价为+1,价,反应后被还原为NaCl,化合价为-1,每1mol的Cl得到2mol的电子,则电子转移的物质的量为32mol, S的化合价在反应前为-![]() ,反应后为+6价,每1mol的S化合价升高数值为(6+
,反应后为+6价,每1mol的S化合价升高数值为(6+![]() ),则xmol的S化合价升高6x+2价,由于在氧化还原和反应化合价升降总数相等,所以6x+2=32,解得x=5。故选A。
),则xmol的S化合价升高6x+2价,由于在氧化还原和反应化合价升降总数相等,所以6x+2=32,解得x=5。故选A。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂或分离方法不正确的是
选项 | 提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | 苯甲酸(可溶性杂质) | 水 | 重结晶 |
A. A B. B C. C D. D