题目内容
【题目】NaCl样品中含有少量的Na2SO4和Na2CO3,按下列流程进行净化。
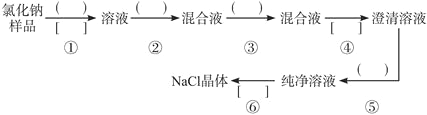
(1)流程第②③步中应分别使用________、_________试剂,第⑥步中应进行_________操作
(2)写出第⑤步发生反应的化学方程式:______________________。
【答案】BaCl2溶液 Na2CO3溶液 蒸发结晶 Na2CO3+2HCl=2NaCl+H2O+CO2↑
【解析】
氯化钠中含有硫酸钠和碳酸钠,应加入过量的氯化钡除去,氯化钡有剩余,再加入过量的碳酸钠除去钡离子,过滤后向滤液中加入盐酸除去碳酸钠,最后加热蒸发结晶即可得氯化钠晶体。
氯化钠中含有硫酸钠和碳酸钠,先加水溶解,然后加入过量的氯化钡除去,氯化钡有剩余,再加入过量的碳酸钠除去钡离子,过滤后向滤液中加入盐酸除去碳酸钠,最后加热蒸发结晶即可得氯化钠晶体。所以①为加水溶解,②为加入过量的氯化钡溶液,③为加入过量的碳酸钠溶液,④为过滤,⑤为加入过量的盐酸溶液除去碳酸钠,⑥为加热蒸发结晶。(1)根据分析②为加入过量的氯化钡溶液,③为加入过量的碳酸钠溶液,⑥为蒸发结晶;
(2). ⑤为加入过量的盐酸,与碳酸钠反应生成氯化钠和水和二氧化碳,方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑。

练习册系列答案
相关题目