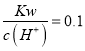题目内容
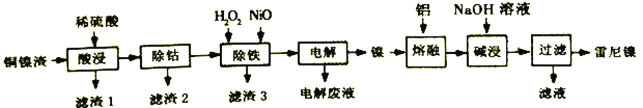
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。
【答案】 2Cu+4H++O2═2Cu2++H2O 1:2 3.3≤pH<7.7或[3.3, 7.7) 硫酸或H2SO4 2Al+2OH-+2H2O═2AlO2-+3H2↑ 新制雷尼镍吸附了大量氢气 AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
【解析】试题分析:(1)根据题意,“酸浸”时,“滤渣1”是铜,通入空气并不断搅拌,铜、氧气、硫酸反应生成硫酸铜和水;(2)1mol Fe2+失1mol电子,1mol H2O2得2mol电子,根据电子守恒计算n(H2O2):n(Fe2+);加入NiO以调节溶液的pH,目的让Fe3+完全转化为沉淀,而Ni2+不能沉淀;(3)根据电解原理,以惰性材料作电极电解硫酸镍生成镍、氧气、硫酸;(4)“碱浸”时,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;新制雷尼镍吸附了大量氢气;(5)“滤液”主要成分是偏铝酸钠,偏铝酸钠与过量CO2反应生成氢氧化铝沉淀和碳酸氢钠;
解析:(1)根据题意,“酸浸”时,“滤渣1”是铜,通入空气并不断搅拌,铜、氧气、硫酸反应生成硫酸铜和水,反应离子方程式是2Cu+4H++O2═2Cu2++H2O;(2)1mol Fe2+失1mol电子,1mol H2O2得2mol电子,根据电子守恒n(H2O2):n(Fe2+)=1:2;加入NiO以调节溶液的pH,目的是让Fe3+完全转化为沉淀,而Ni2+不能沉淀,所以应控制pH的范围为3.3≤pH<7.7;(3)根据电解原理,以惰性材料作电极电解硫酸镍生成镍、氧气、硫酸,根据流程图,可以循环利用的物质是硫酸;(4)“碱浸”时,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑;新制雷尼镍吸附了大量氢气,所以不加氢气也可实现氢化;(5)“滤液”主要成分是偏铝酸钠,偏铝酸钠与过量CO2反应生成氢氧化铝沉淀和碳酸氢钠,反应离子方程式是AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;