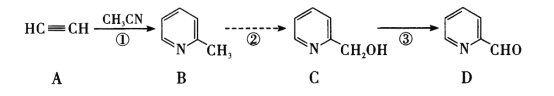
题目内容
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________。
②溶液中的水存在H3O+、![]() 等微粒形式,
等微粒形式,![]() 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则![]() 的结构式为___________。
的结构式为___________。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
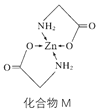
①1 mol M含有的σ键的数目为___________。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、![]() 等,NH3的分子空间构型为____________,
等,NH3的分子空间构型为____________,![]() 的中心氮原子杂化方式为__________。
的中心氮原子杂化方式为__________。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
熔点/℃ | 872 | 283 | 394 |
则ZnX2熔点如表变化的原因是____________________。
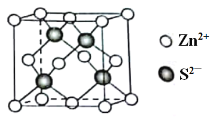
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加德罗常数的值。则该晶体的密度为________g·cm-3(写计算表达式)。
【答案】ds [Ar]3d104p1 由于Cu2+对配体NH3的孤电子对吸引力大,配位键强  20NA 三角锥形 sp杂化 变少 ZnF2为离子晶体,熔点最高;ZnCl2、ZnBr2分子晶体,ZnBr2的相对分子质量大,分子间作用力,熔沸点较高
20NA 三角锥形 sp杂化 变少 ZnF2为离子晶体,熔点最高;ZnCl2、ZnBr2分子晶体,ZnBr2的相对分子质量大,分子间作用力,熔沸点较高 
【解析】
(1)Cu为29号元素,Zn为30号元素,据此分析其在元素周期表中的位置;
(3)①单键均为σ键,双键或三键中有一个σ键,配位键为σ键;
②根据价层电子对互斥理论判断空间构型,根据等电子体理论判断杂化方式;
(4)先判断晶体类型,离子晶体的熔点与晶格能有关;分子晶体的熔点与分子间作用力有关;
(5)先根据晶胞半径计算晶胞棱长,确定晶胞体积,再根据均摊法确定晶胞内各原子的数目,确定晶胞质量,根据![]() 计算密度。
计算密度。
(1)Cu为29号元素,位于周期表中第4周期第ⅠB族,为ds区元素,Zn在周期表中位于第4周期ⅡB族,属于ds区元素,Cu的核外电子排布式为[Ar]3d104s1,焰色反应时 Cu 的 4s 电子会跃迁至 4p 轨道,则Cu 的激发态电子排布式为:[Ar]3d104p1或1s22s22p63s23p63d104p1;
(2)①由于Cu2+对配体NH3的孤电子对吸引力大,配位键强,所以NH3与Cu2+形成配合物的能力大于Mg2+;
②H5O2+可看作是H3O+与H2O通过氢键形成的离子,结构式为: ;
;
(3)①C—C单键、C—H单键、N—C单键、C—O单键、N—H单键均为σ键,C=O双键中有一个σ键,O原子、N原子与Zn之间的配位键为σ键,所以1个M含有20个σ键,所以1molM含有的σ键个数为20NA;
②NH3分子中心原子的价层电子对数为![]() =4,含一对孤电子对,所以为三角锥形;
=4,含一对孤电子对,所以为三角锥形;![]() 与CO2原子总数相同,价电子总数相同,二者互为等电子体,CO2为直线形分子,C原子为sp杂化,所以
与CO2原子总数相同,价电子总数相同,二者互为等电子体,CO2为直线形分子,C原子为sp杂化,所以![]() 中心 N 原子杂化方式为sp杂化;
中心 N 原子杂化方式为sp杂化;
③M 在人体内吸收率高的原因可能是锌形成配合物后,电荷变少,可在消化道内维持良好的稳定性;
(4)由表中熔点数据可知,ZnF2与其他两种的晶体类型不同,ZnF2为离子晶体,熔点最高;ZnCl2、ZnBr2为分子晶体,ZnBr2的相对分子质量大,分子间作用力,熔沸点较高;
(5)根据该硫化物的晶胞结构可知,S2-位于Zn2+的正四面体中心,根据几何关系,晶胞的体对角线为S2-和Zn2+的半径之和的4倍,设晶胞的棱长为a,则有![]() a=4(r1+r2),所以晶胞棱长a=
a=4(r1+r2),所以晶胞棱长a=![]() pm,则晶胞的体积V=
pm,则晶胞的体积V=![]() pm3;根据均摊法,晶胞内Zn2+的个数为
pm3;根据均摊法,晶胞内Zn2+的个数为![]() =4,S2-的个数为4,所以晶胞的质量m=
=4,S2-的个数为4,所以晶胞的质量m=![]() ,所以晶体的密度为ρ=
,所以晶体的密度为ρ= =
= g·cm-3。
g·cm-3。