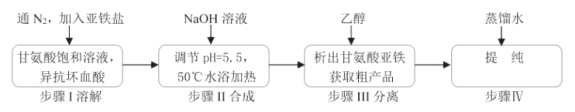
题目内容
【题目】(1)在101kPa时,H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热为___,表示H2燃烧热的热化学方程式为___。
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H= +206.2kJ·mol-1,CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1,则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____。
②由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据,则N2(g)+3H2(g)![]() 2NH3(g) △H=__kJ·mol-1。
2NH3(g) △H=__kJ·mol-1。
化学键 | H-H | N-H | N≡N |
键能kJ·mol-1 | 436 | 391 | 945 |
【答案】285.8kJ/mol H2(g)+![]() O2(g)=H2O(l) △H= -285.8kJ·mol-1 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H= +165.0kJ·mol-1 -93
O2(g)=H2O(l) △H= -285.8kJ·mol-1 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H= +165.0kJ·mol-1 -93
【解析】
(1)在101kPa时,1mol H2(g)完全燃烧生成稳定的氧化物时,释放的热量为燃烧热;
(2)①根据盖斯定律求解;
(1)在101kPa时,反应物为2mol H2(g)、1mol O2(g),H2O(l)为生成物,燃烧热为1mol H2(g)完全燃烧生成液态水时释放的热量,则燃烧热为285.8kJ/mol;燃烧热的热化学方程式为H2(g)+![]() O2(g)═H2O(l) △H= -285.8kJ·mol-1;
O2(g)═H2O(l) △H= -285.8kJ·mol-1;
(2)① i CH4(g)+H2O(g)═CO(g)+3H2(g) △H= +206.2kJ·mol-1,ii CH4(g)+CO2(g)═2CO(g)+2H2(g) △H= +247.4kJ·mol-1,根据盖斯定律,i×2-ii即可得到CH4(g)+2H2O(g)═CO2(g)+4H2(g),则△H= +206.2kJ/mol×2-247.4kJ/mol= +165.0kJ·mol-1;
②化学反应中,旧键的断裂吸收热量,新键的形成释放热量,则△H=945+436×3-391×6= -93kJ·mol-1。

【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________。
②溶液中的水存在H3O+、![]() 等微粒形式,
等微粒形式,![]() 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则![]() 的结构式为___________。
的结构式为___________。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:

①1 mol M含有的σ键的数目为___________。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、![]() 等,NH3的分子空间构型为____________,
等,NH3的分子空间构型为____________,![]() 的中心氮原子杂化方式为__________。
的中心氮原子杂化方式为__________。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
熔点/℃ | 872 | 283 | 394 |
则ZnX2熔点如表变化的原因是____________________。
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加德罗常数的值。则该晶体的密度为________g·cm-3(写计算表达式)。

【题目】800℃时,在2 L密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g),该反应体系中n(NO)随时间的变化如下表:
2NO2(g),该反应体系中n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.022 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
下列有关说法不正确的是
A. 用氧气表示0~3 s内该反应的平均速率ν(O2)=0.0025 mol·L-1·s-1
B. 容器内颜色保持不变时,说明该反应达到平衡状态
C. 增大氧气的浓度,既加快反应速率,又使平衡正向移动
D. 该反应达到平衡时,转移电子总数为0.03NA