题目内容
9.N2+3H2$\frac{\underline{\;一定条件\;}}{\;}$2NH3,是工业上制造氮肥的重要反应.下列关于该反应的说法正确的是( )| A. | 增加N2的浓度能加快反应速率 | |
| B. | 降低体系温度能加快反应速率 | |
| C. | 使用催化剂不影响反应速率 | |
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
分析 该反应为可逆反应,反应物的转化率不可能达到100%,结合浓度、温度、催化剂对反应速率的影响解答该题.
解答 解:A.反应物的浓度增大,反应速率增大,故A正确;
B.升高温度能增大反应速率,则降低温度减小反应速率,故B错误;
C.加入催化剂能增大反应速率,故C错误;
D.该反应为可逆反应,反应物的转化率不可能达到100%,故D错误.
故选A.
点评 本题考查化学反应速率的影响,题目难度不大,注意可逆反应的特点,可逆反应正逆反应同时进行,反应物不可能完全转化.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
20.下列叙述中正确的是( )
| A. | 化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 离子化合物中一定有金属元素和非金属元素 | |
| C. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
1.在指定环境中,下列各组离子一定能够大量共存的是( )
| A. | 在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液中:NH4+、Ca2+、C1-、K+ |
18.下列变化中,属于化学变化的是( )
| A. | 石油分馏 | B. | 碘片升华 | C. | 食盐熔化 | D. | 煤的干馏 |
19.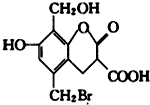 某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )
某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )
 某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )
某有机物的结构简式如图,取足量的Na、NaOH 溶液和NaHCO3溶液分别和等物质的量的该有机物在一定的条件下反应(必要时可以加热),完全反应后消耗Na、NaOH和 NaHCO3三种物质的物质的量之比为( )| A. | 3:4:2 | B. | 3:5:2 | C. | 3:5:1 | D. | 3:4:1 |
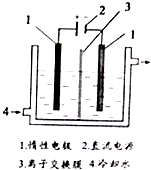 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题: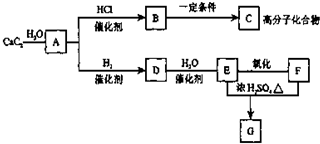 根据如图,回答问题.
根据如图,回答问题. ,GCH3COOCH2CH3
,GCH3COOCH2CH3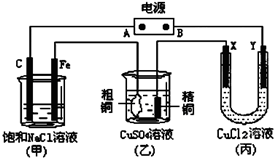 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题: