题目内容
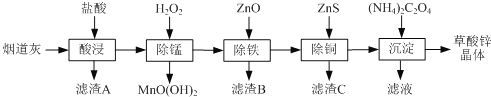
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣B的主要成分为________ 。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为________。
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为___________。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是________。
(4)若沉淀过程采用Na2C2O4代替草酸铵晶体生产草酸锌,合理的加料方式是________。
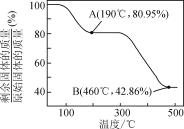
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300 ℃~460 ℃范围内,发生反应的化学方程式为________。
【答案】Fe(OH)3 Mn2++H2O2+H2O===MnO(OH)2↓+2H+ 3.3~5.4 先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去 在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中 ZnC2O4![]() ZnO+CO↑+CO2↑
ZnO+CO↑+CO2↑
【解析】
分析题给流程和信息知烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)加入盐酸酸浸发生反应:ZnO+2HCl=ZnCl2+H2O、6HCl+Fe2O3=2FeCl3+3H2O、CuO+2HCl=CuCl2+H2O、MnO+2HCl=MnCl2+H2O,过滤,滤渣A为SiO2,滤液为氯化锌、氯化铁、氯化铜和二氯化锰的混合液,向滤液中加入H2O2,二氯化锰与H2O2发生氧化还原反应生成MnO(OH)2沉淀,过滤,除去锰元素;加入ZnO调节pH>3.3,Fe3+转化为氢氧化铁沉淀而除去,然后加入ZnS固体,发生反应:Cu2++ZnS=Zn2++CuS,除去Cu2+,最后向滤液中加入草酸铵得草酸锌晶体,据此答题。
(1)根据流程图可知,“除铁”过程中加入ZnO调节pH>3.3,Fe3+转化为氢氧化铁沉淀而除去,所以滤渣B的主要成分为Fe(OH)3,
故答案为:Fe(OH)3。
(2)根据流程图提供的信息,由酸浸进入除锰步骤时,锰元素的存在形式是Mn2+,再加入氧化剂H2O2发生氧化还原反应生成MnO(OH)2沉淀,利用化合价升降法结合原子守恒、电荷守恒配平,离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+,故答案为:Mn2++H2O2+H2O=MnO(OH)2↓+2H+。
(3)①除铁(部分Cu2+可能被除去)时Zn2+不能生成沉淀,分析表中数据知加入ZnO控制反应液pH的范围为3.3~5.4,故答案为:3.3~5.4。
②除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去,故答案为:先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去。
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中,故答案为:在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中。
(5)ZnC2O4·2H2O晶体中ZnC2O4的百分含量为153/189×100%=80.95%,ZnO的百分含量为81/189×100%=42.86%,分析草酸锌晶体加热分解的热重曲线知A点固体为ZnC2O4,B点固体为ZnO,则300℃~460℃范围内发生反应的化学方程式为ZnC2O4![]() ZnO+CO↑+CO2↑,故答案为:ZnC2O4
ZnO+CO↑+CO2↑,故答案为:ZnC2O4![]() ZnO+CO↑+CO2↑。
ZnO+CO↑+CO2↑。

【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),失电子能力最强的原子是______,得电子能力最强的单质与水反应的化学方程式是______________,常温下单质为液态的非金属单质是____________;
(2)⑦⑧⑨气氢化物的稳定性:________>________>________
(3)写出③的单质置换出⑥的单质的化学方程式:__________________;
①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为_____________;
⑨的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的离子方程式为________。