��Ŀ����
����Ŀ��Ϊ��֤ͬ����Ԫ�����ʵĵݱ���ɡ�ijС������ͼ��ʾ��װ�ý���ʵ��(�г���������ȥ��װ���������Ѽ���)��

ʵ����̣�
��.���ɼУ�����a���μ�Ũ���ᡣ
��.��װ��B��װ��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��װ��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��.����
��1������NaOH��Һ����������____________________________��
��2��װ��A�з������û���Ӧ�Ļ�ѧ����ʽΪ___________________��
��3��װ��B����Һ��NaBr��ȫ��������������Cl2�����ʵ���Ϊ__________��
��4��Ϊ��֤��Ԫ�صķǽ�����ǿ�ڵ�Ԫ�أ����̢��IJ�����������__________��
���𰸡� �����ݳ���Cl2����ֹ��Ⱦ���� Cl2+2KI=I2+2KCl 0.005mol ����b����װ��C�е�������Һ����װ��D�У�Ȼ��رջ���b��ȡ��װ��D�����ú�CCl4 ���Ϊ�Ϻ�ɫ
��������
��֤±�ص��������Ե����ǿ����װ��A�и��������Һ��Ũ���ᷴӦ�����Ȼ��̡��Ȼ��ء�������ˮ����������ǿ�����ԣ���ƿ�϶�ʪ��ĵ⻯�ص�����ֽ����ɫ����֤������������ǿ�ڵ⣬װ��B��ʢ���廯�ƣ���������װ��B�У���������������Ϊ�嵥�ʣ���Һ�ʳȺ�ɫ����֤�ȵ�������ǿ���壬�����ж����ܱ������������գ������������Ƶ�����ֹ������Ⱦ��������B��C�е���Һ����Ϊ��ɫʱ���н����ɼУ�Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ��˵���д����������ɣ���ʱӦ�رջ���a����������������Ӱ��ʵ����ۣ��Դ˽����⡣
��1�������ж���Ҫβ�������������NaOH��Һ�����������������ݳ���Cl2����ֹ��Ⱦ������
��2���������������ԣ���⻯�ط����û���Ӧ����Ӧ�Ļ�ѧ����ʽΪCl2+2KI=I2+2KCl��
��3��������������ǿ���壬������ͨ��NaBr��Һ�л��е��������ɣ�������Ӧ�ķ���ʽΪCl2+2NaBr��Br2+2NaCl���廯�Ƶ����ʵ�����0.01L��1mol/L��0.01mol�����ݷ���ʽ��֪����������0.005mol��
��4��Ϊ��֤���������ǿ�ڵ⣬Ӧ��C�����ɵ�����뵽ʢ��KI��Һ��D�У��緢��������ԭ��Ӧ��������CCl4����Һ��Ϊ�Ϻ�ɫ����ʵ�����Ϊ������b����װ��C�е�������Һ����װ��D�У�Ȼ��رջ���b��ȡ��װ��D�����ú�CCl4���Ϊ�Ϻ�ɫ��

 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�����Ŀ����ѧ��һ��ʵ���ѧ����ѧ��Ӧ�����е������仯�����ʱ仯����ѧ��ѧ�о�����Ҫ����
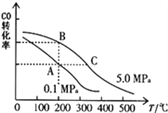
��.������ͼ��ʾװ�òⶨ�к���
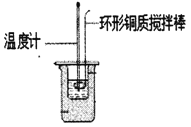
(1)ͼ��������һ������,��ָ��___________
(2)________(������������������)��Ba(OH)2 ��Һ�������������������Һ����������к��Ȳⶨ
��.̽������ͭ�����������������ʵ�Ӱ�졣�����������Ļ����Һ�ֱ���뵽6��ʢ�й���Zn���ķ�Ӧƿ�У��ռ����������壬��¼�����ͬ������������ʱ�䡣
ʵ�� �����Һ | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
����CuSO4��Һ/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(1) ����ɴ�ʵ����ƣ�����: V8=_________
(2) ��CuSO4��Һ����ʱ����Ӧ�������Լӿ죬ԭ��_______
(3) �������CuSO4��Һ����һ����ʱ���������������ʷ������½���������������������½�����Ҫԭ��:______________
����Ŀ����֪��25��ʱijЩ����ĵ���ƽ�ⳣ��������ͼ���ʾ������ϡ��CH3COOH��HClO�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ����
CH3COOH | HClO | H2CO3 |
Ka=1.8��10-3 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
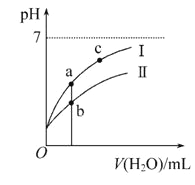
A. ��ͬŨ��CH3COONa��NaClO�Ļ��Һ��,������Ũ�ȵĴ�С��ϵ��c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. ��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��2ClO-+CO2+H2O=2HClO+CO32-
C. ͼ����a�������Ũ�ȴ���b�������Ũ��
D. ͼ����a��c���㴦����Һ��![]() ���(HR����CH3COOH��HClO)
���(HR����CH3COOH��HClO)
����Ŀ��T1��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������A�����B���壬�������·�Ӧ��A(g) +2B(g)![]() C(p)����Ӧ�����вⶨ�IJ������ݼ��±���
C(p)����Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(A)/mol | n(B)/ mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
����˵���������
A. ǰ10min�ڷ�Ӧ��ƽ������Ϊv(C)=0.0250 mnol��L-1��min-1
B. ���������������䣬��ʼʱ�������г���0.50molA�����0.60mo1B���壬����ƽ��ʱ��n(C)<0.25mo1
C. ������������ʱ����ƽ����ϵ���ٳ���0.50molA����ԭƽ����ȣ���ƽ��ʱB��ת��������A�������������
D. �¶�ΪT2��ʱ(T1>T2)��������Ӧƽ�ⳣ��Ϊ20��������ӦΪ���ȷ�Ӧ