题目内容
【题目】
深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
请回答下列问题:
(1)①Fe2+基态核外电子排布式为_____。
②![]() 的空间构型为______(用文字描述)。
的空间构型为______(用文字描述)。
③(CN)2分子中碳原子杂化轨道类型为_______,一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____(填晶体类型)。
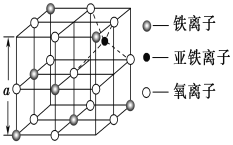
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
【答案】1s22s22p63s23p63d6或[Ar]3d6 三角锥形 sp ![]() 或
或![]() 12 5 分子晶体 是 正八面体 x=
12 5 分子晶体 是 正八面体 x=![]()
【解析】
(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理写出Fe2+基态离子核外电子排布式;
②三角锥形,根据价层电子对互斥理论,它本来是正四面体形的,但是有一对孤电子对要排斥它,据此解答;
③原子数相同,电子总数相同的分子,互称为等电子体,等电子体的结构相似;
(2)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;分子晶体的熔沸点较低;
(3)由图示可知晶体中的氧离子构成面心立方最密堆积,该立方体中氧离子数目为12×1/4+1=4,Fe3+的数目为4×1/8+3×1/2=2,Fe2+的数目为1,则Fe和O的原子数目为3:4,是Fe3O4的晶胞;立方体中三价铁离子周围有6个氧离子围成的正八面体空隙中心;
(4)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV计算。
(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为[Ar]3d6。本小题答案为:1s22s22p63s23p63d6 或[Ar]3d6。
②三角锥形,根据价层电子对互斥理论,它本来是正四面体形的,但是有一对孤电子对要排斥它,就形成三角锥形。本小题答案为:三角锥形。
③(CN)2分子的分子结构为![]() ,碳原子采取sp杂化;与CN-互为等电子体的分子有CO或N2,电子式为
,碳原子采取sp杂化;与CN-互为等电子体的分子有CO或N2,电子式为![]() 或
或![]() 。本小题答案为:sp;
。本小题答案为:sp;![]() 或
或![]() 。
。
(2)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题中所给信息可知,该物质的熔沸点较低,所以为分子晶体。本小题答案为:5;分子晶体。
(3)由图示可知晶体中的氧离子构成面心立方最密堆积,该立方体中氧离子数目为12×1/4+1=4,Fe3+的数目为4×1/8+3×1/2=2,Fe2+的数目为1,则Fe和O的原子数目为3:4,是Fe3O4的晶胞;立方体中三价铁离子周围有6个氧离子围成的正八面体空隙中心。本小题答案为:是;正八面体。
(4)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV可知:4×(56x+16)/NAg=5.71gcm3×(4.28×108cm)3,解得:x=![]() 。本小答案为:x=
。本小答案为:x=![]() 。
。

【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
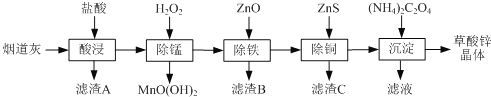
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣B的主要成分为________ 。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为________。
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为___________。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是________。
(4)若沉淀过程采用Na2C2O4代替草酸铵晶体生产草酸锌,合理的加料方式是________。
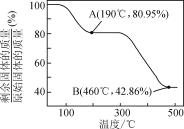
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300 ℃~460 ℃范围内,发生反应的化学方程式为________。