题目内容
【题目】锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示:

请回答下列问題:
(1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。
(2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。
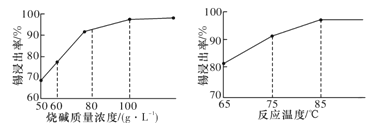
(3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。
【答案】 SnO2+2NaOH= Na2SnO3+H2O 把SnO氧化为SnO32— 蒸发结晶 100g·L-1烧碱浓度、温度85℃ PbO22- + S2- + 2H2O═PbS↓+ 4OH- 5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH
SnO2+2NaOH= Na2SnO3+H2O 把SnO氧化为SnO32— 蒸发结晶 100g·L-1烧碱浓度、温度85℃ PbO22- + S2- + 2H2O═PbS↓+ 4OH- 5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH
【解析】
由流程图可知,向锡锑渣中加入烧碱溶液,Sn、Sb、As、Pb的氧化物溶于氢氧化钠得到含有SnO32—、SbO43—、PbO22-、AsO43—的碱浸液,向碱浸液中加入氢氧化钡溶液,AsO43—与氢氧化钡反应生成砷酸钡沉淀过滤除去;向所得滤液中加入硫化钠溶液,PbO22-与硫化钠发生氧化还原反应生成硫化铅沉淀过滤除去;再向所得滤液中加入锡片,锡与SbO43—发生置换反应生成单质锑过滤除去,得到Na2SnO3溶液。
(1)Sn与碳同主族,Sn的原子序数为50,最外层电子数为4,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)NaNO3具有氧化性,能将SnO氧化,“碱浸”时,若SnO含量较高,工业上则加入NaNO3,其作用是把SnO氧化成SnO32-,故答案为:把SnO氧化为SnO32—;
(3)由图可知,烧碱浓度为100g·L-1,温度为85℃时,锡浸出率最高,故答案为:100g·L-1烧碱浓度、温度85℃;
(4)由题意可知,Na2PbO2溶液与硫化钠溶液发生氧化还原反应生成硫化铅沉淀和氢氧化钠,反应的离子方程式为PbO22- + S2- + 2H2O═PbS↓+ 4OH-,故答案为:PbO22- + S2- + 2H2O═PbS↓+ 4OH-;
(5)由流程图可知,“脱锑”时加入锡,锡与Na3SbO4溶液发生氧化还原反应生成Sb、Na2SnO3和NaOH,反应的化学方程式为5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH,故答案为:5Sn + 4Na3SbO4 + H2O ═ 4Sb + 5Na2SnO3 + 2NaOH。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
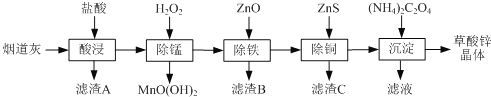
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣B的主要成分为________ 。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为________。
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为___________。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是________。
(4)若沉淀过程采用Na2C2O4代替草酸铵晶体生产草酸锌,合理的加料方式是________。
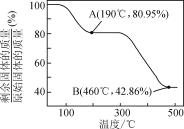
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300 ℃~460 ℃范围内,发生反应的化学方程式为________。