��Ŀ����
����Ŀ�������γɶ��ֻ������Fe��SCN��3��[Fe��CO��5]���ʻ������������������������й㷺Ӧ�á�
��1��Fe3+��̬��������Ų�ʽΪ_____��
��2��ʵ������KSCN��Һ��������Һ����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ____����SCN���е�̼ԭ�ӵ��ӻ��������Ϊ_____����SCN����Ϊ�ȵ�����ķ�����_____��
��3���ʻ���[Fe��CO��5]������������1mol[Fe��CO��5]�����к�������ĿΪ_____��
��4��ij�ֵ����������ľ�����ͼ��ʾ���õ���������Ļ�ѧʽΪ_____��
���𰸡�![]() N>O>S sp CO2(COS��) 10NA��6.02��1024 Fe3N
N>O>S sp CO2(COS��) 10NA��6.02��1024 Fe3N
��������
��1��Feλ�ڵ�4���ڵڢ����壬��۵����Ų�ʽΪ3d64s2��ʧȥ3�������γ�Fe3+����4s��ʼʧȥ���ӣ���2��ͬһ����Ԫ�صĵ�һ����������ԭ��������������������ƣ���Ԫ��2p�ܼ����ڰ����ȶ�״̬�������ͣ�ͬһ����Ԫ�صĵ�һ����������ԭ���������������С��SCN��Ϊֱ���νṹ���ȵ�������ָԭ��������ͬ���۵�������Ҳ��ͬ������
��3���ʻ�������У�����Fe������CO֮���γ���λ����CO�����У�C��O֮�京��һ����λ������4�����ݾ�̯�����㵪��������Ļ�ѧʽ��
��1��Feλ�ڵ�4���ڵڢ����壬��۵����Ų�ʽΪ3d64s2��ʧȥ3�������γ�Fe3+����4s��ʼʧȥ���ӣ�����Fe3+��̬��������Ų�ʽΪ��[Ar]3d5���ʴ�Ϊ��[Ar]3d5��
��2��ͬһ����Ԫ�صĵ�һ����������ԭ��������������������ƣ���Ԫ��2p�ܼ����ڰ����ȶ�״̬�������ͣ�ͬһ����Ԫ�صĵ�һ����������ԭ���������������С������N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ��N��O��S��SCN��Ϊֱ���νṹ��������CΪsp�ӻ���
�ȵ�������ָԭ��������ͬ���۵�������Ҳ��ͬ������������SCN����Ϊ�ȵ�����ķ����ǣ�CO2��COS�ȣ����ʴ�Ϊ��N��O��S��sp��CO2��COS�ȣ���
��3���ʻ�������У�����Fe������CO֮���γ���λ����CO�����У�C��O֮�京��һ����λ��������1mol[Fe(CO)5]�����к�������ĿΪ10 NA���ʴ�Ϊ��10NA��6.02��1024��
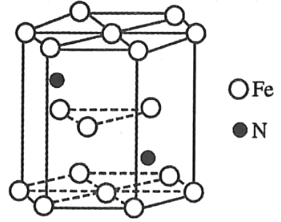
��4������������Ϊ�����������㹱����Ϊ![]() ����㹱����Ϊ
����㹱����Ϊ![]() �����ݾ����ṹ��֪��12����ԭ��λ�ڶ��㣬2����ԭ��λ�����ģ�3����ԭ��λ�����ڣ�2����ԭ��λ�����ڣ�1����������������Ϊ��12��
�����ݾ����ṹ��֪��12����ԭ��λ�ڶ��㣬2����ԭ��λ�����ģ�3����ԭ��λ�����ڣ�2����ԭ��λ�����ڣ�1����������������Ϊ��12��![]() +2��
+2��![]() +3��6������ԭ����Ϊ2�����Ըþ�������������������֮��Ϊ��6��2��3��1�����Ի�ѧ��ΪFe3N���ʴ�Ϊ��Fe3N��
+3��6������ԭ����Ϊ2�����Ըþ�������������������֮��Ϊ��6��2��3��1�����Ի�ѧ��ΪFe3N���ʴ�Ϊ��Fe3N��

 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�����Ŀ��ij��ȤС���Ʊ�����������������
ʵ��1 |
| ʵ������ |
Һ���Ϸ�������ɫ��״������Ѹ�ٱ�Ϊ����ɫ�����Թܱ����к��ɫ�������ɡ� |
(1)ʵ��1�в�����ɫ���������ӷ���ʽ��_______��
(2)Ϊ��̽�����������ɫ��ԭ��С��ͬѧչ������̽����
�ټ�ͬѧ�Ʋ����ɫ����ΪFe(OH)2��Fe(OH)3�����������Ϻ���ݵ�ɫԭ����Ϊ��ɫ�ͺ��ɫ�ĵ���ɫ�������ǻ���ɫ�������ʵ��֤ʵ����ɫ�����в�����Fe(OH)3��������______��
����ͬѧ�������ף�Fe(OH)2�ڴ���SO42-���ڵ�������γ�Fe6(SO4)2(OH)4O3(һ�ֻ���ɫ������ʽ����)������ƶԱ�ʵ��֤ʵ�ü��裺���Թ��м���________�������Թ��м���_________����������ʵ��1��ͬ�������Ǹü��費������
����ͬѧ�����������ף�Fe(OH)2�������н�ǿ���������ܣ�����ɫ��������Fe(OH)2��������Fe2+�����Ʋ����õ�����������Һ��Ũ��ӦԽСԽ�ã�����������ҺŨ��ӦԽ��Խ�á����������ʵ�鷽����
�Թ���10mLNaOH��Һ | �μ�FeSO4��Һ | ʵ������ | |
ʵ��2 | 6 mol/LNaOH��Һ | 0.2mol/L FeSO4��Һ | ����������Һ��İ�ɫ����(������������ɫ)�������³��ֻ���ɫ��Ϊ��ɫ���� |
ʵ��3 | 6 mol/LNaOH��Һ | 0.1mol/L FeSO4��Һ | ����������Һ��İ�ɫ����(���м���������ɫ)�������³��ײ���Ϊ��ɫ���� |
��ʵ��ó��Ľ�����________����ͬѧ��Ϊ��ʵ�鷽��������֤������ɫ����Fe(OH)2��������Fe2+����ģ����貹���ʵ����__________��֤���ü��������
(3)��������ʵ��̽�������������Ƶð�ɫFe(OH)2��������Ҫ���Ƶ�ʵ������_____��
(4)��������ᵼ������NaOH��Һ��Ũ��ƫ�ߵ���_______��
A.NaOH��Һδ��ȴ�����¾ͽ��ж��� B.����ǰ����ƿ����������ˮ
C.������Һʱ����������ƿ�̶��� D.��ˮʱ�����̶��ߣ��ý�ͷ�ι�����
����Ŀ������ʵ�����������ͽ��۶���ȷ����
ѡ�� | ���� | ���� | ���� |
A | ������ǯ��һ�������ھƾ��������� | �����ۻ������� | ���������۵�ϵ� |
B | ������������Һ�еμ��������ᣬ������������ͨ��Ʒ����Һ | Ʒ����Һ��ɫ | �ǽ����ԣ� |
C | ����ɰֽ��ȥ����Ĥ��þƬ����Ƭ����С����״��ͬ�����ֱ����ͬŨ�ȵ�ϡ������ | þƬ��������������ʴ�����Ƭ | ��ԭ�ԣ� |
D | �����£���������С��ͬ�������ֱ����Ũ�����ϡ������ | Ũ����������������ϡ�����в������� | ϡ����������Ա�Ũ����ǿ |
A.AB.BC.CD.D