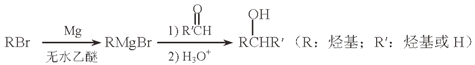
��Ŀ����
����Ŀ��ij��ȤС���Ʊ�����������������
ʵ��1 |
| ʵ������ |
Һ���Ϸ�������ɫ��״������Ѹ�ٱ�Ϊ����ɫ�����Թܱ����к��ɫ�������ɡ� |
(1)ʵ��1�в�����ɫ���������ӷ���ʽ��_______��
(2)Ϊ��̽�����������ɫ��ԭ��С��ͬѧչ������̽����
�ټ�ͬѧ�Ʋ����ɫ����ΪFe(OH)2��Fe(OH)3�����������Ϻ���ݵ�ɫԭ����Ϊ��ɫ�ͺ��ɫ�ĵ���ɫ�������ǻ���ɫ�������ʵ��֤ʵ����ɫ�����в�����Fe(OH)3��������______��
����ͬѧ�������ף�Fe(OH)2�ڴ���SO42-���ڵ�������γ�Fe6(SO4)2(OH)4O3(һ�ֻ���ɫ������ʽ����)������ƶԱ�ʵ��֤ʵ�ü��裺���Թ��м���________�������Թ��м���_________����������ʵ��1��ͬ�������Ǹü��費������
����ͬѧ�����������ף�Fe(OH)2�������н�ǿ���������ܣ�����ɫ��������Fe(OH)2��������Fe2+�����Ʋ����õ�����������Һ��Ũ��ӦԽСԽ�ã�����������ҺŨ��ӦԽ��Խ�á����������ʵ�鷽����
�Թ���10mLNaOH��Һ | �μ�FeSO4��Һ | ʵ������ | |
ʵ��2 | 6 mol/LNaOH��Һ | 0.2mol/L FeSO4��Һ | ����������Һ��İ�ɫ����(������������ɫ)�������³��ֻ���ɫ��Ϊ��ɫ���� |
ʵ��3 | 6 mol/LNaOH��Һ | 0.1mol/L FeSO4��Һ | ����������Һ��İ�ɫ����(���м���������ɫ)�������³��ײ���Ϊ��ɫ���� |
��ʵ��ó��Ľ�����________����ͬѧ��Ϊ��ʵ�鷽��������֤������ɫ����Fe(OH)2��������Fe2+����ģ����貹���ʵ����__________��֤���ü��������
(3)��������ʵ��̽�������������Ƶð�ɫFe(OH)2��������Ҫ���Ƶ�ʵ������_____��
(4)��������ᵼ������NaOH��Һ��Ũ��ƫ�ߵ���_______��
A.NaOH��Һδ��ȴ�����¾ͽ��ж��� B.����ǰ����ƿ����������ˮ
C.������Һʱ����������ƿ�̶��� D.��ˮʱ�����̶��ߣ��ý�ͷ�ι�����
���𰸡�Fe2++2OH-=Fe(OH)2�� ȡһ�����Ļ���ɫ���������������ܽ⣬�ټ���KSCN��Һ������Һ�����ɫ����֤������ɫ�����в�����Fe(OH)3 2mL 0.1mol/LFeCl2��Һ 3��0.1mol/L NaOH��Һ ������������ҺŨ��һ���������£�����������Һ��Ũ��ԽС��������ɫ����������Խ���� ��ʵ��2(��ʵ��3)�İ�ɫ�����м����������������������Һ����ɫ������ɻ���ɫ ���������������������������������ƹ���������������Ũ��С������������Ũ�ȴ� AC
��������
(1)FeSO4��NaOH��Һ�������ֽⷴӦ����Fe(OH)2��ɫ������
(2)�ٽ�����ɫ�����������ܽ⣬Ȼ�����Fe3+�����ʣ���SCN-���飻
�ڸ���ʵ��һ������
�۲��öԱ�ʵ�飬���ݿ��Ʊ�����������
(3)����Fe2+���ױ����������ʵ��1��2��3�Ľ��۷������
(4)����c=![]() �������ʵ���Ũ����Һ������
�������ʵ���Ũ����Һ������
(1)FeSO4��NaOH��Һ�������ֽⷴӦ����Fe(OH)2��ɫ��������Ӧ�����ӷ���Ϊ��Fe2++2OH-=Fe(OH)2����
(2)��Fe(OH)3��������ˮ������ᷴӦ���������Ե����Σ������Һ�м���KSCN��Һ������Һ�����ɫ����֤������ɫ�����в�����Fe(OH)3��
�����Թ��м���2mL0.1mol/LFeCl2��Һ�������Թ��м���3��0.1mol/L NaOH��Һ����������ʵ��1��ͬ�������Ǹü��費������
�۸���ʵ��2��3��֪����NaOHŨ����ͬʱ������������Һ��Ũ��ԽС��������ɫ����������Խ���ԣ���ͬѧ��Ϊ��ʵ�鷽��������֤������ɫ����Fe(OH)2��������Fe2+����ģ����貹���ʵ������ʵ��2(��ʵ��3)�İ�ɫ�����м����������������������Һ����ɫ������ɻ���ɫ��֤���ü��������
(3)����Fe2+���ױ������е���������������Ҫ�����ܸ������������ʵ��1��2��3�Ľ���Ҫʹ������������(���������ƹ���)����������Ũ��С(����������Ũ�ȴ�)�ȴ�ʩ�ſ����Ƶð�ɫFe(OH)2������
(4) A.NaOH��Һδ��ȴ�����¾ͽ��ж��ݣ�����Һ�ָ�������ʱ����Һ��Һ����ڿ̶��ߣ���Һ�����ƫС������������ҺŨ��ƫ�ߣ�A�������⣻
B.����ǰ����ƿ����������ˮ�����ڲ�Ӱ�����ʺ���Һ���������˶����Ƶ���ҺŨ����Ӱ�죬B���������⣻
C.������Һʱ����������ƿ�̶��ߣ���Һ�����ƫС���������Ƶ���ҺŨ��ƫ�ߣ�C�������⣻
D.��ˮʱ�����̶��ߣ��ý�ͷ�ι���������Һ�����ƫ�������Ƶ���ҺŨ��ƫ�ͣ�D���������⣻
�ʺ���ѡ����AC��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�