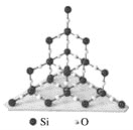
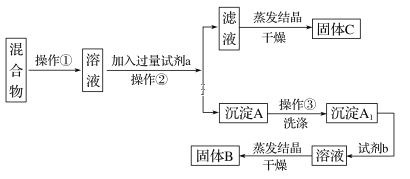
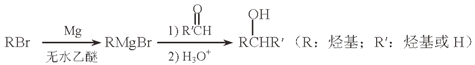
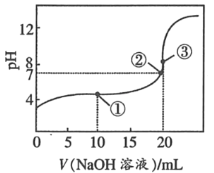
��Ŀ����
����Ŀ���Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��CuFeS2��ұ��ͭ�Ĺ����������£�

��֪��CuFeS2+3CuCl2��4CuCl+FeCl2+2S
��1����ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ_____��
��2��������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ_____��
��3��������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽���������_____���������ӷ��ţ�
��4������3������Һ�п���ѭ��ʹ�õ�������_____��Ϊ�������̳���ѭ����ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ_____��
��5��ұ�����ջ����Խ���ѡ��Ļ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ����ѧ����ʽΪ��6CuFeS2+13O2![]() 3Cu2S+2Fe3O4+9SO2��Cu2S+O2
3Cu2S+2Fe3O4+9SO2��Cu2S+O2![]() 2Cu+SO2�˹�����ǰһ���������Ҫȱ����_____��
2Cu+SO2�˹�����ǰһ���������Ҫȱ����_____��
���𰸡�CuFeS2+ 3FeCl3��CuCl + 4FeCl2+ 2S Fe2O3 Cu2+ CuCl2��HCl�� 0.5mol �������Ⱦ����������SO2���ܺĸߵ�
��������
CuFeS2����CuCl2��ȡ����CuFeS2+3CuCl2��4CuCl+FeCl2+2S�����˺�õ���Һ����FeCl2�����庬��CuCl��S��������������˵õ���Һ����[CuCl2]����������ҺpH�����绯��Ӧ����Cu��Cu2+�����˿ɵõ�Cu���õ���Һ����Cu2+���Դ˽����⡣
CuFeS2����CuCl2��ȡ����CuFeS2+3CuCl2��4CuCl+FeCl2+2S�����˺�õ���Һ����FeCl2�����庬��CuCl��S��������������˵õ���Һ����[CuCl2]����������ҺpH�����绯��Ӧ����Cu��Cu2+�����˿ɵõ�Cu���õ���Һ����Cu2+��
��1��CuFeS2��3FeCl3֮�䷢������������ԭ��Ӧ����ѧ����ʽΪ��CuFeS2+3FeCl3��CuCl+4FeCl2+2S���ʴ�Ϊ��CuFeS2 + 3FeCl3��CuCl + 4FeCl2 + 2S��
��2������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ���ˮ�����������������������������������������������������������շֽ����������������ù���ΪFe2O3���ʴ�Ϊ��Fe2O3��
��3�����˵õ���Һ����[CuCl2]����������ҺpH�����绯��Ӧ����Cu��Cu2+���ʴ�Ϊ��Cu2+��
��4����3������Һ�к���HCl��CuCl2������ѭ��ʹ�ã��漰��Ӧ��CuFeS2+3CuCl2��4CuCl+FeCl2+2S��2CuCl��Cu+CuCl2���ۺ�������ѧ����ʽ�ɵ�CuFeS2+CuCl2��2Cu+FeCl2+2S���ɷ���ʽ�ɵ�ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ0.5mol��
�ʴ�Ϊ��CuCl2(HCl)��0.5mol��
��5������ѡ��Ļ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ�����ɶ����������壬��Ⱦ���������ܺĸߣ��ʴ�Ϊ���������Ⱦ����������SO2���ܺĸߵȡ�