题目内容
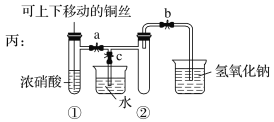
【题目】化学让生活更美好。他一直在践行,如消除饮用水中的有毒物质,保证人民的生活质量。
(1)饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,可以在过量NaOH溶液的条件下用铝粉将
的浓度,可以在过量NaOH溶液的条件下用铝粉将![]() 还原为N2,写出其其离子方程式为:______________________________________________。
还原为N2,写出其其离子方程式为:______________________________________________。
上述反应中,_________元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子。当有1mol N2生成时,反应中转移电子的数目为____________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为__________________________________________________。(已知,氯气在石灰乳中发生歧化反应,其中一种产物是Ca(ClO)2)
(3)KA1(SO4)212H2O的俗名为_________,因其溶于水生成_____________(化学式)可以吸附杂质,从而达到净水作用。
【答案】10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O Al 失去 6.02×1024 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 明矾 Al(OH)3
【解析】
本题是一个常见的信息给予题,只要根据学过的铝、氯气、胶体的知识来解答即可。
(1)铝在碱性条件下的氧化产物为![]() ,该过程失去3个电子,
,该过程失去3个电子,![]() 被还原成0价的
被还原成0价的![]() ,该过程得到5个电子,因此氧化剂和还原剂的计量数之比为3:5,结合原子守恒和电荷守恒,反应的离子方程式为:
,该过程得到5个电子,因此氧化剂和还原剂的计量数之比为3:5,结合原子守恒和电荷守恒,反应的离子方程式为:![]() ;该过程中铝元素的化合价升高,失去电子。根据化学计量数之比可知:当生成3mol
;该过程中铝元素的化合价升高,失去电子。根据化学计量数之比可知:当生成3mol![]() 时,反应一共转移了30mol电子,则当生成1mol
时,反应一共转移了30mol电子,则当生成1mol![]() 时,反应中转移的电子数为10NA;
时,反应中转移的电子数为10NA;
(2)题目告诉我们氯气在石灰乳中发生了歧化反应,Cl元素的化合价一部分升高为+1价,另一部分降低到-1价,即生成![]() ,据此写出化学方程式为:
,据此写出化学方程式为:![]() ;
;
(3)十二水合硫酸铝钾即我们常说的明矾,它净水的原理是因为铝离子在水中可以水解产生氢氧化铝胶体,胶体具有吸附性,从而达到净水的作用。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
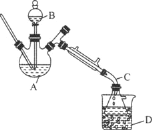
同步拓展阅读系列答案【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
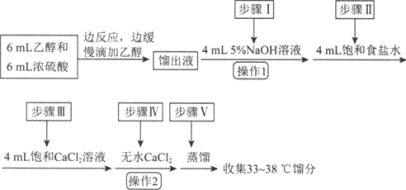
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是________________。
(4)仪器D中盛有冰水混合物,其作用为________________。
(5)操作1的名称为________,操作2的名称为________。
(6)若省略步骤Ⅱ会导致的后果是________。