题目内容
17.下列有关元素周期表中的某些推断正确的是( )| A. | 位于同一主族的元素的价电子数相同,则各元素的常见化合价也一定相同 | |
| B. | 碱金属族元素同卤族元素一样,其单质的熔沸点随元素原子序数的增大而逐渐升高 | |
| C. | 若x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是ⅢA族 | |
| D. | 在周期表中金属和非金属元素的分界线附近的元素是过渡元素 |
分析 A.ⅦA族中氟元素没有正化合价,同族其它元素都有正化合价;
B.碱金属随原子序数的增大,半径增大,金属键减弱;卤素单质随原子序数的增大,相对分子质量增大;
C.ⅡB族、ⅢA族相邻,ⅡB处于第12列,ⅢA族处于第13列;
D.过渡元素包含副族、Ⅷ族元素.
解答 解:A.ⅦA族中氟元素没有正化合价,同族其它元素都有正化合价,故A错误;
B.碱金属随原子序数的增大,半径增大,金属键减弱,则熔沸点逐渐降低;卤素单质随原子序数的增大,相对分子质量增大,则熔沸点逐渐升高,故B错误;
C.ⅡB处于第12列,ⅢA族处于第13列,x是ⅡB族中元素的原子序数,原子序数为x+1的元素一定处于ⅢA族,故C正确;
D.金属与非金属元素的分界线附近的元素,通常既具有金属性又具有非金属性,过渡元素包含副族、Ⅷ族元素,故D错误;
故选:C.
点评 本题考查结构性质位置关系、元素周期表的结构等,难度不大,注意把握元素周期表结构.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
7.下列实验中,不能观察到明显变化的是( )
| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把 Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入水中 | |
| D. | 氢氟酸滴到玻璃上 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,44 g C3H8中含有的碳碳单键数为3 NA | |
| C. | 6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
2.某芳香烃的分子式为C9H12,其苯环上一氯代物只有两种同分异构体有几种( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
9.下列分子中的中心原子的杂化类型为sp2杂化的是( )
| A. | BeCl2 | B. | NH3 | C. | BF3 | D. | H2O |
6.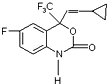 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )| A. | 该物质易溶于水 | |
| B. | M能发生缩聚反应 | |
| C. | M分子内至少有15个原子在同一个平面上 | |
| D. | M的分子式为C13H22O2NF4 |
7.下列推断正确的是( )
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: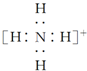 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键D |
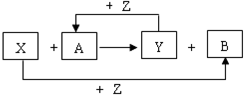 X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):
X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应): ;
; 或
或 ;
;