题目内容
5. 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)(1)图象中V(HCl)在0~150mL区间内发生反应的化学方程式为NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3.
(2)盐酸的物质的量浓度为0.4mol/L.
(3)该样品中NaOH与Na2CO3的物质的量之比为2:1.
分析 (1)因为碳酸钠与盐酸反应生成碳酸氢钠,与碳酸氢钠与盐酸反应生成二氧化碳消耗盐酸的物质的量相等,所以由图可知V(HCl)在0~100mL区间内发生反应的化学方程式为:NaOH+HCl=NaCl+H2O;在100~150mL区间内发生反应的化学方程式为Na2CO3+HCl=NaCl+NaHCO3;
(2)加入150mL~200mL盐酸,发生反应:NaHCO3+HCl═NaCl+CO2↑+H2O,根据生成二氧化碳计算n(HCl),再根据c=$\frac{n}{V}$计算;
(3)加入200mL盐酸时,生成0.448L二氧化碳,此时溶液中溶质为NaCl,由氯离子守恒计算n(NaCl),根据碳元素守恒计算n(Na2CO3),根据钠离子守恒计算n(NaOH),据此解答.
解答 解:(1)因为碳酸钠与盐酸反应生成碳酸氢钠,与碳酸氢钠与盐酸反应生成二氧化碳消耗盐酸的物质的量相等,所以由图可知V(HCl)在0~100mL区间内发生反应的化学方程式为:NaOH+HCl=NaCl+H2O;在100~150mL区间内发生反应的化学方程式为Na2CO3+HCl=NaCl+NaHCO3,
故答案为:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3;
(2)加入150mL~200mL盐酸,消耗盐酸体积=200mL-150mL=50mL,生成0.448L二氧化碳,其物质的量=$\frac{0.448L}{22.4L/mol}$=0.02mol,则:
NaHCO3 +HCl═NaCl+CO2↑+H2O,
1 1
n(HCl) 0.02mol
则n(HCl)=0.02mol,则c(HCl)=$\frac{0.02mol}{0.05L}$=0.4mol/L,
故答案为:0.4;
(3)加入200mL盐酸时,生成0.448L二氧化碳,此时溶液中溶质为NaCl,
由氯离子守恒可知n(NaCl)=0.2L×0.4mol/L=0.08mol,
根据碳元素守恒n(Na2CO3)=n(CO2)=0.02mol,
根据钠离子守恒n(NaOH)=n(NaCl)-2n(Na2CO3)=0.08mol-0.02mol×2=0.04mol,
故该样品中NaOH与Na2CO3物质的量之比=0.04mol:0.02mol=2:1,
故答案为:2:1.
点评 本题以图象形式考查化学方程式计算,明确发生的反应是解题关键,注意(3)中利用守恒思想进行解答.

| A. | 升高温度 | B. | 将容器的体积缩小一半 | ||
| C. | 增加C的量 | D. | 降低温度 |
| A. | 近年来雾霾天气越来越频繁,导致雾霾形成的主要污染物是PM2.5 | |
| B. | 垃圾分类既有利于保护生态环境,又能变废为宝,如图 为可回收物标志 为可回收物标志 | |
| C. | 选择环保的装修材料可以有效地减少居室污染,劣质合板释放出的主要污染物CO | |
| D. | 自来水有硬水和软水之分,含有钙、镁离子的水称之为硬水,不含有钙、镁离子的水称之为软水 |
| A. | KNO3(NaCl)--结晶 | B. | 水(酒精)--分液 | ||
| C. | Cu(Fe)--溶于足量盐酸,过滤 | D. | CO2(HCl)--饱和碳酸氢钠溶液,洗气 |

 ;
;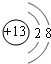 ,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.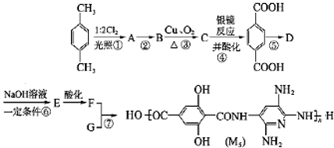
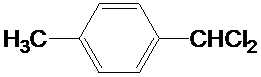 (写结构简式)
(写结构简式)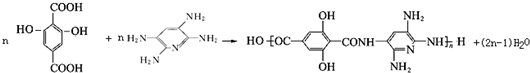 .
.