题目内容
A、B、C、D、E、F均为短周期元素,原子序数依次递增.A元素原子核内无中子.B元素原子最外层电子数是次外层电子数的2倍.C元素是地壳是含量最多的元素.D是短周期元素中金属性最强的元素.E与F的位置相邻,F的最高价氧化物的水化物为最强的酸.
(1)推断B在元素周期表中的位置: .
(2)写出A与C形成的10电子的阳离子化学式: .(用对应的化学符号填空,下同)
(3)E、F两种元素中非金属性较强的是 ;用电子式表示D2C形成过程
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为: (从大到小排列).
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式: .
(6)甲是A和C按原子个数比1:1组成的化合物.已知甲的溶液能使酸性高锰酸钾溶液褪色.将含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为 .
(1)推断B在元素周期表中的位置:
(2)写出A与C形成的10电子的阳离子化学式:
(3)E、F两种元素中非金属性较强的是
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:
(6)甲是A和C按原子个数比1:1组成的化合物.已知甲的溶液能使酸性高锰酸钾溶液褪色.将含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为
分析:A、B、C、D、E、F均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;C元素是地壳中含量最多的元素,则C为氧元素;D元素是短周期元素中金属性最强的元素,则D为Na;E与F的位置相邻,F的最高价氧化物的水化物为最强的酸,可推知E为S元素、F为Cl元素,据此解答.
解答:解:A、B、C、D、E、F均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;C元素是地壳中含量最多的元素,则C为氧元素;D元素是短周期元素中金属性最强的元素,则D为Na;E与F的位置相邻,F的最高价氧化物的水化物为最强的酸,可推知E为S元素、F为Cl元素,
(1)B是碳元素,原子有2个电子层,最外层电子数为4,在元素周期表中的位置:第二周期第IVA族,故答案为:第二周期第IVA族;
(2)H与O形成的10电子的阳离子化学式为:H3O+,故答案为:H3O+;
(3)同周期随原子序数增大非金属性增强,故非金属性Cl>S;用电子式表示Na2O形成过程为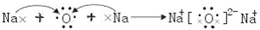 ,
,
故答案为:Cl;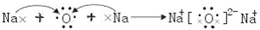 ;
;
(4)Na、S形成的正盐的水溶液中,S2-离子水解,溶液呈碱性,OH-离子来源于水的电离、HS-及S2-离子水解,故C(OH-)>C(HS-),水解程度比较微弱,阴离子的浓度大小为:C(S2-)>C(OH-)>C(HS-),
故答案为:C(S2-)>C(OH-)>C(HS-);
(5)常温下,1mol氢气与与氧气化合,放出286kJ的热量,则该反应的热化学方程式为:H2(g)+
O2(g)═H2O(l)△H=-286kJ/mol,
故答案为:H2(g)+
O2(g)═H2O(l)△H=-286kJ/mol;
(6)甲是H和O按原子个数比1:1组成的化合物,则甲为H2O2,甲的溶液能使酸性高锰酸钾溶液褪色,甲被氧化生成氧气,含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,设Mn元素在还原产物中的化合价为a,根据电子转移守恒,则:0.5mol×2×[0-(-1)]=0.1L×2mol/L×[7-a],解得a=2,还有生成Mn2+,该反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
(1)B是碳元素,原子有2个电子层,最外层电子数为4,在元素周期表中的位置:第二周期第IVA族,故答案为:第二周期第IVA族;
(2)H与O形成的10电子的阳离子化学式为:H3O+,故答案为:H3O+;
(3)同周期随原子序数增大非金属性增强,故非金属性Cl>S;用电子式表示Na2O形成过程为
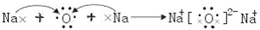 ,
,故答案为:Cl;
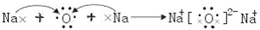 ;
;(4)Na、S形成的正盐的水溶液中,S2-离子水解,溶液呈碱性,OH-离子来源于水的电离、HS-及S2-离子水解,故C(OH-)>C(HS-),水解程度比较微弱,阴离子的浓度大小为:C(S2-)>C(OH-)>C(HS-),
故答案为:C(S2-)>C(OH-)>C(HS-);
(5)常温下,1mol氢气与与氧气化合,放出286kJ的热量,则该反应的热化学方程式为:H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(6)甲是H和O按原子个数比1:1组成的化合物,则甲为H2O2,甲的溶液能使酸性高锰酸钾溶液褪色,甲被氧化生成氧气,含有0.5mol甲的溶液滴加到100mL 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,设Mn元素在还原产物中的化合价为a,根据电子转移守恒,则:0.5mol×2×[0-(-1)]=0.1L×2mol/L×[7-a],解得a=2,还有生成Mn2+,该反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
点评:本题考查结构性质位置关系应用,涉及电子式、盐类水解、热化学方程式、氧化还原反应等,侧重对知识的理解与迁移应用能力考查,难度中等.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.