题目内容
16.设NA为阿伏伽德罗常数的数值,下列叙述不正确的是( )| A. | 标准状况下,4.4g CO2中含有的原子数为0.3NA | |
| B. | 标准状况下,22.4L甲烷中含有的C-H键数为4NA | |
| C. | 5.6g 铁粉与硝酸反应失去的电子数可能为0.25NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 |
分析 A.根据n=$\frac{m}{M}$计算出二氧化碳的物质的量,再计算出含有的原子数;
B.甲烷分子中含有4个碳氢键,标况下22.4L甲烷的物质的量为1mol,含有4mol碳氢键;
C.铁为变价金属,产物化合价可能为+2或+3价,5.6g铁的物质的量为0.1mol,失去的电子介于0.2~0.3mol之间;
D.氧化钠溶于1L水中,所得溶液体积不是1L.
解答 解:A.4.4g CO2的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,含有的原子数为0.3NA,故A正确;
B.标准状况下,22.4L甲烷的物质的量为1mol,含有4mol碳氢键,含有的C-H键数为4NA,故B正确;
C.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,0.1mol铁与足量稀硝酸反应中,最多失去0.3mol电子,最少失去0.2mol电子,所以失去的电子数可能为0.25NA,故C正确;
D.含NA个Na+的Na2O溶解于1L水中,钠离子的物质的量为1mol,但是溶液的体积不是1L,溶液的物质的量浓度不是1 mol•L-1,故D错误;
故选D.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题知识点较多,充分考查了学生灵活应用基础知识的能力,D为易错点,注意所得溶液体积不是1L.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
6.某有机物的结构简式为CH2=CHCH2-CH2OH,下列对其化学性质的判断中,不正确的( )
| A. | 一定条件下能发生加聚反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 该有机物能发生加成反应但不能发生催化氧化生成醛 | |
| D. | 1mol该有机物能与足量的金属钠反应放出0.5mol H2 |
4.下列反应中硫酸既表现出了强氧化性又表现了酸性的是( )
| A. | 氧化铜与硫酸反应 | B. | 氢氧化铝与硫酸反应 | ||
| C. | 木炭粉与浓硫酸反应 | D. | 铜与浓硫酸反应 |
11.下列元素中属于主族元素的是( )
| A. | 铁 | B. | 硫 | C. | 氮 | D. | 碘 |
1.已知:CH3(CH2)2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2878kJ•mol-1
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
| A. | 正丁烷的燃烧热为-2878kJ•mol-1 | |
| B. | 正丁烷分子所具有的能量大于异丁烷分子 | |
| C. | 等量的异丁烷分子中碳氢键比正丁烷的多 | |
| D. | 异丁烷转化为正丁烷的过程是一个放热过程 |
8.下列能用分液漏斗分离的混合物是( )
| A. | 液溴和四氯化碳 | B. | 乙酸和乙醇 | ||
| C. | 乙酸乙酯和蒸馏水 | D. | 溴苯和苯 |
5.某有机物的结构简式为 ,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
 ,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )
,1mol该物质与足量的NaOH溶液充分反应后,消耗NaOH的物质的量为( )| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |

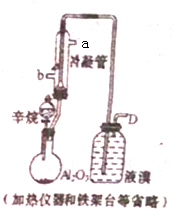 现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,
现以C8H18为原理经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,