题目内容
下列图示与对应的叙述相符的是 
| A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 |
| C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系 |
| D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强 |
C
解析试题分析:A、根据图Ⅰ可以看出反应A(g)=C(g)的△H=[E1-(E4—E3+E2)]kJ·mol-1,错误;B、反应2SO2+O2 2SO3 正向为气体体积减小的反应,扩大容器的体积,平衡逆向移动,二氧化硫和氧气的物质的量增大,三氧化硫的物质的量减小,与图像不符,错误;C、将CO2通入NaOH的稀溶液中,发生的反应依次为CO2+2NaOH====Na2CO3+H2O,Na2CO3 + CO2+ H2O====2NaHCO3,氢氧化钠抑制水的电离,而碳酸钠水解,促进水的电离,水的电离程度逐渐增大,碳酸氢钠的水解程度小于碳酸钠,碳酸抑制水的电离,水的电离程度又逐渐减小,与图像相符,正确;D、由图Ⅳ曲线可知,浓度相同的三种一元酸,HX的pH最大,电离程度最小,HX的酸性最弱,错误。
2SO3 正向为气体体积减小的反应,扩大容器的体积,平衡逆向移动,二氧化硫和氧气的物质的量增大,三氧化硫的物质的量减小,与图像不符,错误;C、将CO2通入NaOH的稀溶液中,发生的反应依次为CO2+2NaOH====Na2CO3+H2O,Na2CO3 + CO2+ H2O====2NaHCO3,氢氧化钠抑制水的电离,而碳酸钠水解,促进水的电离,水的电离程度逐渐增大,碳酸氢钠的水解程度小于碳酸钠,碳酸抑制水的电离,水的电离程度又逐渐减小,与图像相符,正确;D、由图Ⅳ曲线可知,浓度相同的三种一元酸,HX的pH最大,电离程度最小,HX的酸性最弱,错误。
考点:考查与化学相关的图像。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
| A.做该实验时环境温度为22 ℃ |
| B.该实验可分多次把NaOH溶液倒入盛有盐酸的小烧杯中 |
| C.NaOH溶液的浓度约为1.50 mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即可制冷。该化学物质是 ( )
| A.氯化钠 | B.固体硝酸铵 | C.固体氢氧化钠 | D.生石灰 |
下列关于热化学反应的描述中正确的是 ( )
| A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+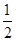 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则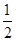 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 |
下列说法中错误的是
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D.需要加热才能发生的化学反应一定是吸热反应 |
下列说法中正确的是
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol |
H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ

下列反应前后物质的总能量变化可用如图表示的是( )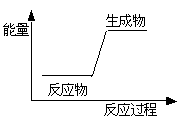
| A.生石灰加水生成熟石灰 |
| B.C+H2O=CO+H2 |
| C.金属钠与水反应 |
| D.HNO3+NaOH=NaNO3+H2O |
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |