题目内容
下列反应前后物质的总能量变化可用如图表示的是( )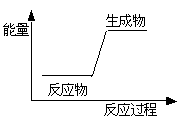
| A.生石灰加水生成熟石灰 |
| B.C+H2O=CO+H2 |
| C.金属钠与水反应 |
| D.HNO3+NaOH=NaNO3+H2O |
B
解析试题分析:在图中由于反应物的能量低,生成物的能量高,发生反应由反应物变为生成物,要从环境中吸收能量。A.生石灰加水生成熟石灰是放热反应,错误。B.C+H2O CO+H2是吸热反应。正确。C.金属钠与水反应是放热反应,错误。D.HNO3+NaOH=NaNO3+H2O酸碱中和反应是放热反应。错误。
CO+H2是吸热反应。正确。C.金属钠与水反应是放热反应,错误。D.HNO3+NaOH=NaNO3+H2O酸碱中和反应是放热反应。错误。
考点:考查图像法在表示化学反应中的能量变化的知识。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
| A.△H1>0,△H3<0 |
| B.△H2>0,△H4>0 |
| C.△H1=△H2+△H3 |
| D.△H3=△H4+△H5 |
下列图示与对应的叙述相符的是 
| A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 |
| C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系 |
| D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强 |
根据右图提供的信息,下列所得结论不正确的是( )
| A.反应物比生成物稳定 | B.该图可以表示石灰石高温分解 |
| C.该反应的△H>0 | D.因为生成物的总能量高于反应物的总能量该反应一定需要加热 |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
| A.-1780kJ/mol | B.-1220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
根据下图,下列判断中正确的是
| A.烧杯a中的溶液pH不变 |
| B.烧杯a中发生氧化反应 |
| C.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
| D.烧杯b中发生的反应为Zn-2e-=Zn2+ |
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔绝了空气
| A.①② | B.①③ | C.②④ | D.③④ |
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C. H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)=== Ba(OH)2(aq)=== BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |

