题目内容
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,
下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5++ OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼—空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
C
解析

练习册系列答案
相关题目
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |
氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2。大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化如图所示,则下列叙述正确的是( )。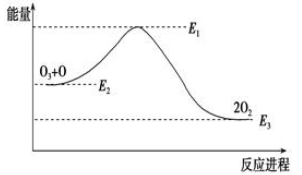
①反应O3+O=2O2的ΔH=E1-E3 ②反应O3+O=2O2是放热反应 ③ΔH=ΔH1+ΔH2 ④大气层中的臭氧无法再生
| A.①② | B.②③ | C.③④ | D.②④ |
下列图示与对应的叙述相符的是 
| A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 |
| C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系 |
| D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强 |
根据右图提供的信息,下列所得结论不正确的是( )
| A.反应物比生成物稳定 | B.该图可以表示石灰石高温分解 |
| C.该反应的△H>0 | D.因为生成物的总能量高于反应物的总能量该反应一定需要加热 |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
| A.-1780kJ/mol | B.-1220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
已知:
①I2(g)+H2(g)  2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g)  2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.I2(g)===I2(s) ΔH=-17.00 kJ/mol |
| C.固态碘的稳定性比气态碘的稳定性高 |
| D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多 |

