题目内容
下列关于热化学反应的描述中正确的是 ( )
| A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+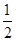 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则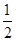 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 |
D
解析试题分析:A、中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,生成2molH2O所放出的热量为2×57.3kJ,但生成硫酸钡沉淀的反应还要吸收热量,则H2SO4和Ba(OH)2反应的反应热小于2×(-57.3)kJ?mol-1,故A错误;B、由燃烧热的概念可知,甲醇燃烧应生成液态水,则CH3OH的燃烧热一定不为192.9kJ?mol-1,故B错误;C、H2(g)的燃烧热是285.8kJ?mol-1,生成液态水,则2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ?mol-1,故C错误;D、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,葡萄糖的燃烧热是2800kJ?mol-1,则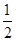 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400kJ?mol-1,故D正确;故选D。
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400kJ?mol-1,故D正确;故选D。
考点:考查燃烧热和中和热

键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ/mol、243kJ/mol和431kJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为( )
| A.放热91.5kJ | B.放热183kJ | C.吸热183kJ | D.吸热91.5kJ |
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
| A.△H1>0,△H3<0 |
| B.△H2>0,△H4>0 |
| C.△H1=△H2+△H3 |
| D.△H3=△H4+△H5 |
下列说法正确的是
| A.物质发生化学反应都伴随着能量变化 |
| B.伴有能量变化的物质变化都是化学变化 |
| C.在一个化学反应中,反应物的总能量与生成物的总能量一定相同 |
| D.在一个化学反应中,反应物的总能量一定高于生成物的总能量 |
氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2。大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化如图所示,则下列叙述正确的是( )。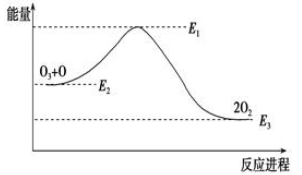
①反应O3+O=2O2的ΔH=E1-E3 ②反应O3+O=2O2是放热反应 ③ΔH=ΔH1+ΔH2 ④大气层中的臭氧无法再生
| A.①② | B.②③ | C.③④ | D.②④ |
“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观象冰。1体积“可燃冰”可储藏100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是
| A.“可燃冰”有可能成为人类未来的重要能源 | B.“可燃冰”是一种比较洁净的能源 |
| C.“可燃冰”提供了水可能变成油的例证 | D.“可燃冰”的主要可燃成分是甲烷 |
下列图示与对应的叙述相符的是 
| A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积 |
| C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系 |
| D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强 |
根据右图提供的信息,下列所得结论不正确的是( )
| A.反应物比生成物稳定 | B.该图可以表示石灰石高温分解 |
| C.该反应的△H>0 | D.因为生成物的总能量高于反应物的总能量该反应一定需要加热 |
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔绝了空气
| A.①② | B.①③ | C.②④ | D.③④ |