题目内容
15.HN3称为叠氮酸,常温下为无色有刺激性气味的液体.N3-也被称为类卤离子.用酸与叠氮化钠反应可制得叠氮酸.而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O.HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症.试回答下列问题:

(1)基态氮原子核外电子排布的轨道表示式为

(2)元素N、P、S的第一电离能(I1)由大到小的顺序为N>P>S
(3)HN3属于分子晶体,与N3-互为等电子体的分子的化学式CO2(写1种)NH2-的电子式为
 ,其中心原子的杂化类型是sp3杂化
,其中心原子的杂化类型是sp3杂化(4)CuCl2-中的键型为配位键,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为7mol
(5)治癌药物B的结构简式为
 .
.
分析 (1)N原子核外有7个电子,分两层排布,根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低;
(2)同一周期,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于第VIA族元素,同一主族,元素的第一电离能随着原子序数的增大而减小;
(3)HN3的构成微粒为分子,叠氮酸为分子晶体;根据等电子体是指具有相同电子数目和原子数目的分子或离子来回答;根据价层电子确定电子式;根据价层电子对互斥理论确定杂化类型,价层电子对个数=σ键个数+孤电子对个数来解答;根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;
(4)Cu2+提供空轨道,Cl-提供孤对对子,配位形成CuCl2-离子,该晶胞中Y原子个数=8×$\frac{1}{8}$=1,Ba原子个数=8×$\frac{1}{4}$=2,Cu原子个数=3,O原子个数=10×$\frac{1}{2}$+2=7;
(5)根据物质的相似相溶原理分析.
解答 解:(1)氮元素的原子核外有7个电子,轨道表示式为 ,
,
故答案为: ;
;
(2)同一周期,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于第VIA族元素P>S,同一主族,元素的第一电离能随着原子序数的增大而减小N>P,所以第一电离能大小顺序是:N>P>S,
故答案为:N>P>S;
(3)叠氮酸为非金属元素组成的共价化合物,属于分子晶体;CNO-中电子数为:6+7+8+1=22,与CO2具有相同电子数目和原子数目,是等电子体,常见粒子还有N2O等;NH2-价层电子对个数为4,含有2个孤对电子,所以电子式为 ,为sp3杂化;
,为sp3杂化;
故答案为:分子;CO2; ;sp3;
;sp3;
(4)该晶胞中Y原子个数=8×$\frac{1}{8}$=1,Ba原子个数=8×$\frac{1}{4}$=2,Cu原子个数=3,O原子个数=10×$\frac{1}{2}$+2=7,所以该物质的化学式为YBa2Cu3O7,
1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为7mol,
故答案为:7mol;
(5)根据物质的相似相溶原理,极性溶质极易溶于极性溶剂,水是极性溶剂,所以此种化合物是极性溶质,其异构体的结构可用示意图表示为: ,
,
故答案为: .
.
点评 本题考查内容较为综合,关于(2)第一电离能变化的趋势为易错点,掌握晶胞的计算、正确判断中心原子的杂化轨道是解本题关键,题目难度中等.

| A. | 乙烯的结构简式:CH2CH2 | B. | 四氯化碳的电子式: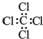 | ||
| C. | 甲烷分子的比例模型: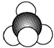 | D. | HClO的结构式:H-Cl-O |
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)③与⑧分别与氢形成的化合物沸点较高的是H2O(用化学式表示).
(3)请写出①与②元素形成的最简单的有机物的电子式:
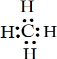
(4)④与⑨两种元素非金属性强弱顺序为:⑨<④(填“>”或“<”或“=”)
(5)⑥、⑦、⑧、⑨四种元素形成的简单离子中,离子半径最大的是S2-(用元素符号表示).
(6)⑦与⑥的最高价氧化物对应的水化物反应的化学反方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
 CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应).
CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应). ;
; 酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.
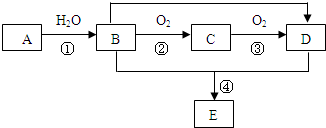
酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.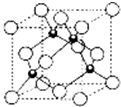 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.
原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.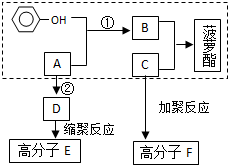 已知方框内是食品香精菠萝酯的生产路线,A、B又能发生方框外所示的转化关系.A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O.信息:-OH和碳碳双键不能连在同一个碳原子上.
已知方框内是食品香精菠萝酯的生产路线,A、B又能发生方框外所示的转化关系.A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O.信息:-OH和碳碳双键不能连在同一个碳原子上.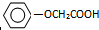 ;E
;E .
. .
. (有几种填写几种).
(有几种填写几种).