题目内容
20.今有a.盐酸,b.硫酸,c.醋酸三种酸,回答下列问题.(用酸的序号及“>”“<”“=”填空)①在同体积、同浓度的三种酸中,分别加入足量的锌粒,在相同条件下产生H2的体积由大到小的顺序是:b>a=c.
②在同体积、同pH的三种酸中,恰好中和氢氧化钠的物质的量c>b=a.
③同pH的三种酸稀释相同倍数后,溶液pH由大到小的顺序a=b>c.
分析 (1)在同体积、同浓度的三种酸中,分别加入足量的锌粒,在相同条件下产生H2的体积和酸的物质的量有关系;
(2)醋酸为弱酸,硫酸为二元强酸,盐酸为一元强酸,同pH时,醋酸浓度最大,硫酸和盐酸中氢离子浓度相同;
(3)将pH相同的三种酸均稀释相同倍数,盐酸、硫酸的变化相同,但醋酸为弱酸,稀释后促进电离,氢离子浓度最大,溶液pH最小.
解答 解:(1)在同体积、同浓度的三种酸中,盐酸、醋酸、硫酸的物质的量是相等的,分别加入足量的锌粒,在相同条件下盐酸和醋酸产生H2的体积一样,但是硫酸是二元酸,加入足量的锌粒,在相同条件下产生H2的体积是盐酸、醋酸的2倍,所以产生H2的体积由大到小的顺序是:b>a=c,
故答案为:b>a=c;
(2)在同体积、同pH的三种酸中,醋酸为弱电解质,则其浓度最大;硫酸和盐酸都是强酸,两溶液中氢离子浓度相等,所以中和氢氧化钠的物质的量大小为:c>b=a,
故答案为:c>b=a;
(3)将pH相同的三种酸均稀释相同倍数后,盐酸、硫酸的变化相同,但醋酸为弱酸,促进电离,则均稀释后溶液的pH由大到小的顺序为:a=b>c,
故答案为:a=b>c.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质电离特点是解本题关键,注意相同pH时弱电解质的浓度大于强电解质,试题培养学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol硫酸铝钾中阴离子所带电荷总数为2NA | |
| B. | 等质量的乙炔和苯分别完全燃烧,乙炔和苯都消耗7.5NA个氧气分子 | |
| C. | 将0.1mol碳酸钠溶于1L水中,所得溶液含有CO32-和HCO3-共0.1NA个 | |
| D. | 在H2O2作燃料电池的负极原料时,每摩尔H2O2转移的电子数为2 NA |
11.下列物质中,属于含有极性共价键的离子化合物的是( )
| A. | MgCl2 | B. | Br2 | C. | KOH | D. | CH3COOH |
12.奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维,该聚酯纤维的结构简式为:
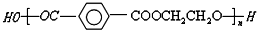 ,下列说法正确的是( )
,下列说法正确的是( )
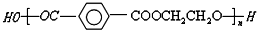 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 羊毛与该聚酯纤维的化学成分相同 | |
| B. | 该聚酯纤维和羊毛在一定条件下均不能水解 | |
| C. | 合成该聚酯纤维的单体为对苯二甲酸和乙二醇 | |
| D. | 由单体合成该聚酯纤维的反应属加聚反应 |
 ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦
 ⑨CH3-CH═CH2(10)CH3-CO-CH3 (11)
⑨CH3-CH═CH2(10)CH3-CO-CH3 (11) (12)
(12)


 ,其中心原子的杂化类型是sp3杂化
,其中心原子的杂化类型是sp3杂化 .
.