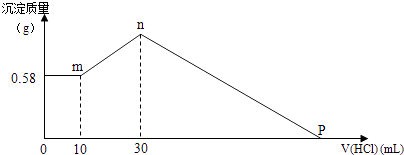
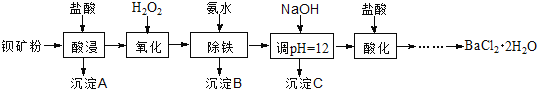
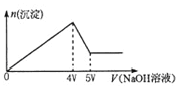题目内容
【题目】已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11- 0℃。

(1)配平该反应化学方程式:____KClO3+ H2C2O4== KHCO3+ ClO2↑
(2)B装置的作用是______________________ 。
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因:_____________。
【答案】 2 1 2 2 将ClO2冷凝收集 过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3(或因KClO3具有较强的氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3)
【解析】试题分析:(1)根据质量守恒和得失电子守恒配平方程式;
(2)ClO2沸点较低,易液化;
(3)草酸可与生成物碳酸氢钾反应生成二氧化碳,或KClO3氧化草酸生成二氧化碳气体;
解析:(1)由质量守恒和得失电子守恒可配平,方程式为2KClO3+H2C2O4=2KHCO3+2ClO2↑;
(2)ClO2沸点较低,易液化,B可起到冷凝收集的作用;
(3)反应后生成KHCO3,过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,也可能为因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3,

【题目】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka] | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断以下说法中不正确的是( )
A.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO![]()
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中这四种酸都没有完全电离
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配置准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠,对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.1molL﹣1的高锰酸钾溶液500mL.
步骤二:取0.2000molL﹣1的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
平行实验编号 | Na2C2O4溶液(mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
1 | 20.00 | 0.00 | 23.18 |
2 | 20.00 | 1.02 | 21.00 |
3 | 20.00 | 1.18 | 21.20 |
试回答下列问题:
(1)步骤一中粗配溶液要用到的主要玻璃仪器除量筒外还需、 .
(2)高锰酸钾溶液应盛装于(填“酸式”或“碱式”)滴定管中:在使用滴定管前,应检查(填部位名称)是否漏水,在确保滴定管不漏水后方可使用;润洗滴定管内壁后的液体应从滴定管的(填“下部放入”或“上口倒入”)预置的烧杯中;步骤二中滴定终点的判断方法是: .
(3)下列滴定操作会导致测量结果偏高的是 .
A.滴定管滴定前有气泡,滴定后气泡消失
B.锥形瓶洗涤后没有干燥
C.滴定终点读数时俯视
D.滴定时锥形瓶中有液体溅出
(4)从实验所得数据计算,KMnO4溶液的浓度为molL﹣1 .