题目内容
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
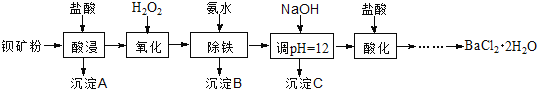
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
【答案】 二氧化硅 将Fe2+氧化成Fe3+ Mg(OH)2 冷却结晶、过滤 Ba2++2F-=BaF2↓ 0.136 4.95
【解析】(1)钡矿粉主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质,其中二氧化硅不溶于盐酸,故滤渣A是二氧化硅。(2)滤液1中含有钡离子、亚铁离子、镁离子、氢离子、氯离子,加入H2O2将亚铁离子氧化为三价铁离子,有利于后续与镁离子的分离;(3)铁元素在除铁步骤中已除云,加NaOH溶液调节pH=12.5,是将镁离子转化为Mg(OH)2沉淀而除去;(4)要得到结晶水合物,常用加热浓缩、冷却结晶、过滤洗涤的方法。(5) BaCl2溶液与氟化铵溶液反应生成氟化钡沉淀,离子方程式为:Ba2++2F-=BaF2↓;由Ksp(BaF2)的表达式可知,c(Ba2+)·c2(F-)= Ksp(BaF2),代入数据:10-5 mol/L×c2(F-)= 1.84×10-7,c(F-)=0.136mol/L;
(6)由关系式可知:
BaCO3 ——BaCl2·2H2O
197 244
5.0 t×80% m m =4.95t

【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。




