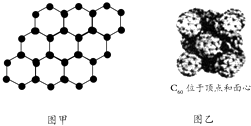
题目内容
【题目】向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )

A. 1:2 B. 1:1 C. 2:3 D. 3:2
【答案】A
【解析】试题分析:向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,在加入NaOH溶液4V时,发生反应形成Al(OH)3、Mg(OH)2沉淀,当再加入NaOH溶液VL时,发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O,可知原溶液中含有Al3+的物质的量是Vmol,其对应的Al2(SO4)3物质的量是V/2mol,根据离子方程式:Al3++3OH-= Al(OH)3↓可知形成氢氧化铝沉淀消耗的NaOH的物质的量是3Vmol,则发生反应:Mg2++2OH-= Mg(OH)2↓消耗的NaOH是V,根据镁元素守恒可知MgCl2的物质的量是V/2mol,所以原溶液中Mg2+与Al3+的物质的量之比是V/2mol: Vmol=1:2,选项A正确。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目