题目内容
【题目】A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:
(1)A原子的结构示意图为
(2)C在周期表中的位置:
(3)BD2含有的化学键类型为
(4)A,C两元素最高价氧化物的水化物相互反应的离子方程式为 .
【答案】
(1)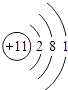
(2)第三周期ⅢA族
(3)离子键
(4)Al(OH)3+OH﹣═AlO2﹣+2H2O
【解析】解:、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族; A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为: ![]() =40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;B元素的单质跟D元素单质反应生成化合物BD2 , B为+2价,则D为﹣1价,所以D为Cl元素,(1)A为Na,其原子序数为11,最外层含有1个电子,Na的原子结构为:
=40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;B元素的单质跟D元素单质反应生成化合物BD2 , B为+2价,则D为﹣1价,所以D为Cl元素,(1)A为Na,其原子序数为11,最外层含有1个电子,Na的原子结构为: 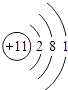 ,所以答案是:
,所以答案是: 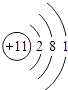 ;(2)C是Al元素,其原子核外有3个电子层、最外层电子数是3,所以C位于第三周期第IIIA族,所以答案是:第三周期ⅢA族;(3)MgCl2中镁离子和氯离子只存在离子键,所以答案是:离子键;(4)A、C两元素最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣═AlO2﹣+2H2O.
;(2)C是Al元素,其原子核外有3个电子层、最外层电子数是3,所以C位于第三周期第IIIA族,所以答案是:第三周期ⅢA族;(3)MgCl2中镁离子和氯离子只存在离子键,所以答案是:离子键;(4)A、C两元素最高价氧化物的水化物分别为NaOH、Al(OH)3 , 二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,所以答案是:Al(OH)3+OH﹣═AlO2﹣+2H2O.

【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾羅的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_____________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
向一定条件下的恒容密用容器中充入NO和CO,用传感器测得该反应在不同时间时NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(NO)=V(CO)
②此条件下达到平衡时,该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下, NaHSO3显___性 (填“酸”“碱”或“中”,判断的理由是(通过计算说明)______。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。
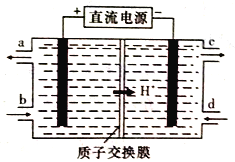
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
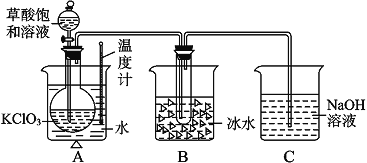
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。