题目内容
20.在透明溶液中能大量共存的是( )| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、HCO3- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.H+、HCO3-结合生成水和气体,不能大量共存,故B错误;
C.Ba2+、SO42-结合生成沉淀,不能大量共存,故C错误;
D.Mg2+、OH-结合生成沉淀,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式推理正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向次氯酸钙溶液中通入二氧化碳气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通入二氧化硫气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 用惰性电极电解CuSO4溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+2H+═Ca2++CO2↑+H2O | 将少量CaCO3粉末投入足量硝酸溶液中 CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
11.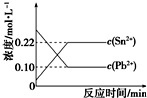 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
5.几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是( )
| 元素代号 | A | B | C | D | E | F | G | H |
| 化合价 | -1 | -2 | +4、-4 | +7、-1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能从GD2溶液中置换出D单质 | |
| B. | G在CB2中燃烧生成两种化合物 | |
| C. | E元素的单质不存在同素异形体 | |
| D. | A、F、H的离子半径由大到小顺序是A>H>F |
12.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 | |
| B. | 1 mol O2在反应中得到电子数一定为4 NA | |
| C. | 1 mol Cl2在反应中得到电子数不一定为2NA | |
| D. | 在2KClO3+4HC1(浓)═2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物,每生成1 mol Cl2转移2 NA 个电子 |
9.已知Rn-离子的质量数为35,中子数为18,核外电子总数为18,则该离子是( )
| A. | Cl- | B. | F - | C. | S2- | D. | Br |
10.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | Na2O和Na2O2都属于碱性氧化物 | B. | KOH和Na2CO3都属于碱 | ||
| C. | NaHSO4和HNO3都属于酸 | D. | Na2O和SiO2都属于氧化物 |
 (用电子式表示).
(用电子式表示).