题目内容
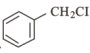
【题目】(1)证明溴乙烷中溴元素的存在,有下列几步,其正确的操作顺序是___。
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入稀硝酸至溶液呈酸性
(2)有机物M结构如图,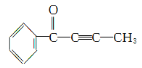 。根据M的结构回答:最多有__个原子共平面。
。根据M的结构回答:最多有__个原子共平面。
(3)某烃A和炔烃B的混合物共1L,完全燃烧生成相同状况下的二氧化碳1.4L,水蒸气1.6L,写出两种烃的结构简式A__,B___。
(4)实验室制取硝基苯的化学反应方程式是___。
(5)溴乙烷水解得到乙醇,乙醇可以发生催化氧化成醛,写出乙醇催化氧化的方程式:___。
【答案】②③④① 17 CH4 CH≡CH ![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
(1)根据溴乙烷是非电解质,不能电离出Br-,可使溴乙烷在碱性条件下发生水解反应得到Br-,向水解后的溶液中加入AgNO3溶液,根据生成的淡黄色沉淀,可以确定溴乙烷中含有溴原子,需要说明的是溴乙烷水解需在碱性条件下进行,加入AgNO3溶液之前需加入稀硝酸酸化,否则溶液中的OH-会干扰Br-的检验;
(2)在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,与双键相连的碳原子为不饱和碳原子;
(3)两种气态烃的混合物共2L,在空气中完全燃烧得到1.4L CO2、1.6L水蒸气,根据相同体积下气体的体积之比等于物质的量之比,结合原子守恒可得平均分子式为C1.4H3.2,所以混合物中烃分子中一定有含有1个碳原子的烃,故一定含有CH4,即A为CH4,炔烃分子中H原子数目小于3.2,故炔烃B为乙炔;
(4)苯与浓硝酸在浓硫酸做催化剂、吸水剂,水浴加热条件下发生取代反应生成硝基苯和水;
(5)乙醇催化氧化反应生成乙醛和水。
(1)证明溴乙烷中溴元素的存在,先发生加入氢氧化钠溶液并加热,发生水解反应生成NaBr,再加入稀硝酸至溶液呈酸性,最后加入硝酸银溶液,生成淡黄色沉淀,则证明含溴元素,即操作顺序为②③④①;
(2)苯、甲醛是平面结构,乙炔是直线型分子,甲基中还有1个氢原子可能在同一平面内,M中最多有17个原子共平面;
(3)两种气态烃的混合物共2L,在空气中完全燃烧得到1.4L CO2、1.6L水蒸气,根据相同体积下气体的体积之比等于物质的量之比,结合原子守恒可得平均分子式为C1.4H3.2,所以混合物中烃分子中一定有含有1个碳原子的烃,故一定含有CH4,即A为CH4,炔烃分子中H原子数目小于3.2,故炔烃B为乙炔,
故答案为:CH4;CH≡CH;
(4)苯和浓硝酸在浓硫酸、加热条件下发生取代反应生成硝基,化学反应方程式为![]() ;
;
(5)乙醇催化氧化反应生成乙醛和水,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。

 新题型全程检测期末冲刺100分系列答案
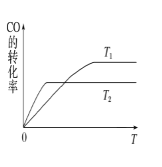
新题型全程检测期末冲刺100分系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)=4NO2(g)+O2(g),△ H>0, T1温度时,向密闭容器中通入N2O5,部分实验数据见表下列说法中不正确的是
时间/s | 0 | 500 | 1000 | 1500 |
c (N2O5) /rnol/L | 5.00 | 3.52 | 2.50 | 2.50 |
A. 500s内用O2表示的平均速率为1.48×10-3mol/(L-s)
B. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
C. T1温度下N2O5的平衡转化率为50%
D. 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时 c(N2O5)>5.00mol/L