题目内容
8.向某盛有7.8gNa2O2的密闭容器中(无空气)通入4.48LNO2(标准状况),然后注入200mL水,充分反应后,容器中所含物质有( )| A. | NaNO2 NO H2O | B. | NaNO3 NaOH O2 H2O | ||
| C. | NaNO3 H2O | D. | NaNO3 HNO3 O2 H2O |
分析 n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,n(NO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,二者发生氧化还原反应,反应方程式为Na2O2+2NO2=2NaNO3,根据方程式知,二者恰好反应,据此分析解答.
解答 解:n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,n(NO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(Na2O2):n(NO2)=0.1mol:0.2mol=1:2,二者发生氧化还原反应,反应方程式为 Na2O2+2NO2=2NaNO3,根据方程式知,二者恰好反应生成NaNO3,所以充分反应后,容器中所含物质有NaNO3、H2O,
故选C.
点评 本题考查混合物的计算,侧重考查分析计算能力,正确书写二者反应方程式是解本题关键,题目难度不大.

练习册系列答案
相关题目
19.下列叙述正确的是( )
| A. | 同周期主族元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中零族元素的单质常温常压下全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大就越容易得电子 | |
| D. | 非金属元素的最低负价都和它的族序数相等 |
3.下列化学用语的书写正确的是( )
| A. | 二氧化硅晶体的分子式:SiO2 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-离子结构示意图: | D. | 四氯化碳的电子式: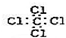 |
13.下列各组中的两种粒子所含电子数相等的是( )
| A. | CH3+和NH4+ | B. | OH-和NH2- | C. | NO2和NO3- | D. | CH4和Na |
20.下列分子式表示的物质,具有同分异构体的是( )
| A. | C4H10 | B. | C3H8 | C. | CH4 | D. | C2H6 |
17.不论以任何比例混合,只要当混合物的质量一定时,混合物完全燃烧后生成的二氧化碳不变的是( )
| A. | 甲苯和乙苯 | B. | 乙烯和丁二烯 | C. | 甲烷和丙烯 | D. | 乙炔和苯 |
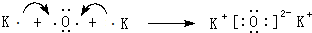 .
.