题目内容
19.0.05mol乙醇和一定量的氧气混合点燃,恰好完全燃烧,放出68.35kJ热量,则该表达该有机物燃烧热的热化学方程式是C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367kJ/mol.分析 有机物燃烧热是指完全燃烧1mol物质生成稳定产物(液态水)所放出的热量,根据热化学方程式的意义:反应焓变和方程式的系数成正比例关系,结合热化学方程式的书写来回答.
解答 解:乙醇燃烧热是指完全燃烧1mol物质生成稳定产物(液态水)所放出的热量,0.05mol乙醇和一定量的氧气混合点燃,恰好完全燃烧,放出68.35kJ热量,则1mol乙醇和一定量的氧气混合点燃,恰好完全燃烧,生成液态水和二氧化碳放出68.35kJ×20=1367kJ的热量,反应的热化学方程式为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367kJ/mol,
故答案为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367kJ/mol.
点评 本题考查了热化学方程式书写和意义的应用,注意掌握基础是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
| A. | 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 | |
| B. | 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 | |
| C. | 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-) | |
| D. | 25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol•L-1 |
7.下列各方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | HS-+H2O?S2-+H3O+ | ||
| C. | HCO3-+OH-?CO32-+H2O | D. | CO32-+H2O?HCO3-+OH- |
14.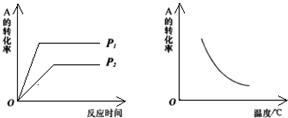 现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )
现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )
 现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )
现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )| A. | a<0,m+n<x | B. | a<0,m+n>x | C. | a>0,m+n<x | D. | a>0,m+n>x |
11.某物质在一定条件下加热分解,产物都是气体.分解方程式为2A$\frac{\underline{\;\;△\;\;}}{\;}$B↑+2C↑+2D↑.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
| A. | 7d | B. | 5d | C. | 2.5d | D. | 2d |
8.主族元素R的最高价氧化物的化学式为R2O5,则它的气态氢化物的化学式是( )
| A. | RH4 | B. | RH3 | C. | H2R | D. | HR |


 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: