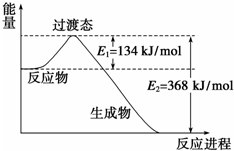
题目内容
14.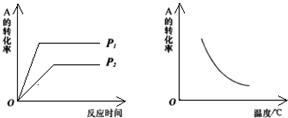 现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )
现有可逆反应m A(g)+n B(g)?x C(g);△H=a kJ/mol.该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示.下列判断正确的是( )| A. | a<0,m+n<x | B. | a<0,m+n>x | C. | a>0,m+n<x | D. | a>0,m+n>x |
分析 根据左图分析到达平衡时所用时间的长短判断压强p1和p2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小;根据右图分析判断,升高温度,化学平衡向吸热方向移动,再结合A的转化率判断该反应的正反应是放热还是吸热.
解答 解:由左图知,p2到达平衡时所用时间长,p1到达平衡时所用时间短,所用压强为p2的反应速率慢,为p1的反应速率快,压强越大反应速率越大,所以p2<p1;增大压强,化学平衡向气体体积减小的方向移动,由图象知,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x,右图知,随着温度的升高,A的转化率减低,平衡向逆反应方向移动,升高温度,平衡向吸热反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即a<0,只有B符合;
故选B.
点评 本题考查化学平衡图象题,题目难度中等,注意温度、压强对反应速率和化学平衡的影响.

练习册系列答案
相关题目
9.下列四组溶液混合后,最先出现浑浊的是( )
| 选项 | H2SO4 | Na2S2O3 | H2O |
| A | 5mL0.1mol/L | 5mL0.1mol/L | 0 |
| B | 5mL0.2mol/L | 5mL0.1mol/L | 10 |
| C | 5mL0.3mol/L | 5mL0.1mol/L | 20 |
| D | 5mL0.4mol/L | 5mL0.1mol/L | 30 |
| A. | A | B. | B | C. | C | D. | D |
6.下列关于胶体和溶液的说法中,正确的是( )
| A. | 分散系的分类 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 光线通过时,溶液产生丁达尔效应,胶体则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
3.同温同压下,下列关于氢气和氯气的叙述中,正确的是( )
①等体积的氢气和氯气所含的分子数相同
②氢分子间的平均距离和氯分子间的平均距离几乎是相等的
③氢分子与氯分子的大小相同
④氢分子和氯分子本身的大小对于气体体积影响可以忽略不计.
①等体积的氢气和氯气所含的分子数相同
②氢分子间的平均距离和氯分子间的平均距离几乎是相等的
③氢分子与氯分子的大小相同
④氢分子和氯分子本身的大小对于气体体积影响可以忽略不计.
| A. | ①②③ | B. | ①②④ | C. | ①②③④ | D. | ①④ |
17. 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
实验结论:Fe的氧化产物为Fe2+和Fe3+.
 为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的热稳定性和氧化性,某化学兴趣小组设计了如下实验.Ⅰ.AgNO3的热稳定性
利用如图所示的实验装置,加热A中的AgNO3固体,试管A中有红棕色气体产生,B中无红棕色气体产生,在装置C中收集到无色气体.当反应结束后,测得试管中残留黑色固体Ag.(夹持及加热仪器均省略)
(1)C中集气瓶收集的气体为氧气,要收集纯净的该气体,正确的操作是等到导气管中气泡均匀放出时再收集.
(2)甲同学认为仅凭试管A中有红棕色的气体产生就判定有NO2产生是错误的,因为无色NO遇到空气也会变成红棕色,所以加热前应当排净装置中的空气,你是否同意他的观点?并说明理由:否;硝酸银分解生成氧气.
Ⅱ.AgNO3的氧化性
将光亮的铁丝伸入盛有AgNO3溶液的大试管中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,猜测如下:
假设一:Fe被氧化成Fe2+;
假设二:Fe被氧化成Fe3+;
假设三:Fe被氧化成Fe2+或Fe3+.
已知:溶液中的Ag+能与SCN-反应,干扰实验.选用如下试剂设计一个实验验证假设三.可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水、盐酸、硝酸、NaCl溶液.完成如表:
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | 白色沉淀 | 除尽Ag+ |
| (2)取少量上层清液于试管中,加入取少量上述溶液于试管中加入 KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上层清液于试管中,加入加入 酸性KMnO4溶液,振荡 | 紫红色消失 | 存在Fe2+ |