题目内容
10.根据反应Zn+Cu2+=Zn2++Cu,设计原电池,下列装置中正确的是( )| A. |  | B. | 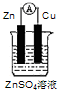 | C. |  | D. | 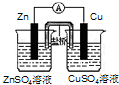 |
分析 根据电池反应式知,失电子的金属作负极,则锌作负极,不如负极活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,所以电解质溶液中含有铜离子,则电解质溶液为可溶性的铜盐,由此分析解答.
解答 解:A、左边烧杯应是硫酸锌,锌失电子沿导线到铜极表面,右边烧杯中的铜离子在铜的表面获得电子,所以右边烧杯是硫酸铜,故A错误;
B、电解质应含有铜离子,而不是锌离子,故B错误;
C、未构成闭合回路,故C错误;
D、装置的电极总反应符合Zn+Cu2+=Zn2++Cu,右边烧杯中的铜离子在铜的表面获得电子,所以右边烧杯是硫酸铜,构成原电池,故D正确;
故选D.
点评 本题考查了原电池工作原理,判断正负极、电解质溶液时,要根据电池反应式判断:发生氧化反应的电极为负极,发生还原反应的电极为正极,含有发生还原反应的离子溶液为电解质溶液.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 一个自发反应,反应物的总能量必须高于生成物的总能量 | |
| B. | 在等温条件下,化学反应的热效应称为焓变 | |
| C. | 化学反应中,发生能量变化的根本原因是化学键的断裂与形成 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
18.一定条件下,在体积为1L的密闭容器中,2mol X和 1mol Y进行反应:2X(g)+Y(g)?Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )
| A. | 同一时间内消耗 2n mol X的同时生成 n mol Z | |
| B. | c(X):c(Y):c(Z)=2:1:1 | |
| C. | 容器内气体的总物质的量不再变化 | |
| D. | 容器内原子总数不再发生变化 |
15.反应4NH3+5O2?4NO+6H2O在一定体积的密闭容器中进行,30s后NO的物质的量浓度增加了3mol/L,则下列反应速率正确的是( )
| A. | v(NO)=0.01mol•(L•s)-1 | B. | v(NO)=0.02mol•(L•s)-1 | ||
| C. | v(NH3)=0.1mol•(L•s)-1 | D. | v(NH3)=0.2mol•(L•s)-1 |