题目内容
14.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )| A. | 钡与水反应不如钠与水反应剧烈 | B. | 钡可以从KCl溶液中置换出钾 | ||
| C. | Ba(OH)2可与NH4Cl反应,反应放热 | D. | 碱性:KOH>Ba(OH)2>NaOH |
分析 A.元素的金属性越强,其单质的还原性越强,其单质与水或酸反应越剧烈;
B.钡的活动性介于Na和K元素之间,所以钡加入盐溶液中先和水反应;
C.Ba(OH)2可与NH4Cl反应,反应吸热;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.元素的金属性越强,其单质的还原性越强,其单质与水或酸反应越剧烈,Ba的金属性介于Na和K元素之间,所以钡与水反应比Na与水反应剧烈,故A错误;
B.钡的活动性介于Na和K元素之间,所以钡加入盐溶液中先和水反应,所以将Ba加入氯化钾溶液中先和水反应生成氢氧化钡,故B错误;
C.Ba(OH)2可与NH4Cl反应,反应吸热,故C错误;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,Ba的金属性介于Na和K元素之间,所以碱性KOH>Ba(OH)2>NaOH,故D正确;
故选D.
点评 本题考查金属元素的性质,明确金属的金属性强弱与其单质的还原性强弱、其最高价氧化物的水化物碱性强弱之间的关系是解本题关键,易错选项是C.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
4.按下列路线制备聚氯乙烯,各步骤中不涉及的反应类型是( )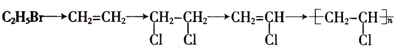
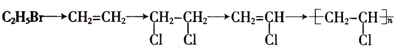
| A. | 消去反应 | B. | 取代反应 | C. | 加成反应 | D. | 加聚反应 |
5.下列事实与胶体性质关的是( )
| A. | 工业生产中常用静电除尘装置除去废气中的固体悬浮物 | |
| B. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| C. | 一束平行光线照射豆浆时,可看到光亮的通路 | |
| D. | 万里长江流入大海处,形成长江三角洲 |
2.辽宁舰航母入列到中国海军极大提升了中国的军心、民心,我国的国防从此又多了一把利器.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 $\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 $\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
| 金属离子 | Fe2+ | Fe3+ | Al3- | Mg2+ | Ni2+ |
| 开始沉淀的pH值 | 6.5 | 1.6 | 3.4 | 9.4 | 7.2 |
| 完全沉淀的pH值 | 9.7 | 3.2 | 5.4 | 12.4 | 9.3 |
9.下列说法不正确的是( )
| A. | 煤的气化和液化是使煤变成清洁能源的有效途径 | |
| B. | 煤的干馏过程属于物理变化,通过干馏可以得到焦炉气、煤焦油、焦炭等产品 | |
| C. | 工业上大量燃烧含硫燃料是形成“酸雨”的主要原因 | |
| D. | 以煤为原料可获得许多合成高分子材料 |
3.下列实验结论不正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 将石蜡油加强热(裂解)所产生的气体通入酸性高锰酸钾溶液中 | 溶液褪色 | 产物不都是烷烃 |
| B | 向盛有3mL鸡蛋清溶液的试管里,滴入几滴浓硝酸 | 鸡蛋清变黄色 | 蛋白质可以发生颜色反应 |
| C | 将碘酒滴到新切开的土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D、 |
4.已知某酸H2B在水溶液中存在下列关系::①H2B?H++HB-,②HB-?H++B2-.则下列关于酸式盐NaHB的溶液
的说法中一定正确的是( )
的说法中一定正确的是( )
| A. | NaHB的电离方程式为:NaHB?Na-+H-+B2- | |
| B. | NaHB溶液一定呈酸性 | |
| C. | NaHB和NaOH溶液反应的离子方程式为H++OH-═H20 | |
| D. | NaHB溶液中一定存在:c(Na+)+c(H+)═c(HB-)+2c(B2-)+c(OH-) |
 ,结构简式H2C=CH2.
,结构简式H2C=CH2.
 ,反应类型是加聚反应.
,反应类型是加聚反应.