题目内容
11.下列指定反应的离子方程式正确的是( )| A. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | NaHCO3溶液与氢氧化钠溶液反应:HCO3-+2OH-═CO2↑+H2O | |
| C. | 用CH3COOH 溶液CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H20═Al(OH)3↓+HCO3- |
分析 A.2mol钠生成1mol氢气,离子方程式两边不满足电子守恒;
B.NaHCO3溶液与NaOH溶液反应碳酸钠和水;
C.碳酸钙为强电解质,不溶于水,在离子反应中保留化学式;
D.二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢根离子.
解答 解:A.钠和水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.NaHCO3溶液与NaOH溶液反应碳酸钠和水,正确的离子方程式为:OH-+HCO3-=CO32-+H2O,故B错误;
C.碳酸钙与醋酸的反应中,碳酸钙和醋酸都不能拆开,正确的离子反应为:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑,故C错误;
D.NaAlO2溶液中通入过量CO2制Al(OH)3,反应的离子方程式为:CO2+AlO2-+2H20═Al(OH)3↓+HCO3-,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确判断离子方程式正误常用方法:检查反应物、生成物的拆分是否正确、是否满足守恒关系(质量守恒、电荷守恒、电子守恒)、是否满足原反应方程式等.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
1.化学与生产、生活息息相关,下列说法正确的是( )
| A. | 绿色化学的核心就是如何对被污染的环境进行无毒、无害化的治理 | |
| B. | 海洋中含有丰富的矿产资源,利用蒸馏的方法可以获得NaCl、Br2和Mg等物质 | |
| C. | 加热可杀灭中东呼吸综合征(MERS)冠状病毒,因为病毒的蛋白质受热变性 | |
| D. | 动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着热能转变成化学能 |
2.辽宁舰航母入列到中国海军极大提升了中国的军心、民心,我国的国防从此又多了一把利器.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 $\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 $\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
| 金属离子 | Fe2+ | Fe3+ | Al3- | Mg2+ | Ni2+ |
| 开始沉淀的pH值 | 6.5 | 1.6 | 3.4 | 9.4 | 7.2 |
| 完全沉淀的pH值 | 9.7 | 3.2 | 5.4 | 12.4 | 9.3 |
3.下列实验结论不正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 将石蜡油加强热(裂解)所产生的气体通入酸性高锰酸钾溶液中 | 溶液褪色 | 产物不都是烷烃 |
| B | 向盛有3mL鸡蛋清溶液的试管里,滴入几滴浓硝酸 | 鸡蛋清变黄色 | 蛋白质可以发生颜色反应 |
| C | 将碘酒滴到新切开的土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D、 |
20.下列实验装置及描述正确的是( )
| A. |  该图装置不能这么碳酸与苯酚的酸性强弱 | |
| B. | 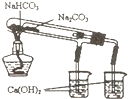 该图可验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 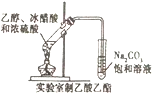 实验室可用该装置制取少量的乙酸乙酯 | |
| D. | 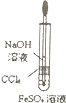 该图装置可用于制备Fe(OH)2 |
11.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,78g Na202中含有的阴离子数为2NA | |
| B. | 常温下,1L 0.1 mol/L NH4NO3溶液中含有的NH4 +数为0.1NA | |
| C. | 标准状况下,22.4 L己烷中含有的共价键的数目为19 NA | |
| D. | 30 g SiO2晶体中含有Si-O键的数目为2 Na |
 ,结构简式H2C=CH2.
,结构简式H2C=CH2.
 ,反应类型是加聚反应.
,反应类型是加聚反应.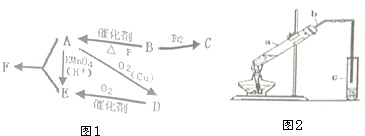 有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题:
有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题: