题目内容
1.I:用尿素、氢氧化钠和水作为溶剂,预冷至零下 12℃,能将极难溶解的纤维素溶化为粘液.武汉大学张俐娜教授因此而荣获美国2011年度安塞姆•佩恩奖.(1)尿素[CO(NH2)2]中元素原子半径最大的原子最外层电子排布式为2S22P2;能说明氧元素原子比氮元素原子得电子能力强的事实是AB(填选项).
A.在NO2中氧元素显负价,氮元素显正价 B.H2O的热稳定性比NH3的稳定
C.常温下H2O是液态而NH3是气态 D.O2比N2易液化
(2)尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请解释其原因NH4++OH-=NH3.H2O=NH3↑+H2O,发生跑氨现象;
II:中国尿素合成塔(尿塔)使用寿命仅为欧美国家的$\frac{1}{4}$.为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理:
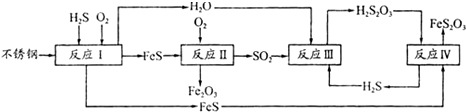
(3)H2S来自合成尿素的天然气.在380K、体积为 2L的密闭容器中,存在如下反应:
H2(g)+S(s)═H2S(g) Q=-21.5kJ/mol.反应达到平衡时H2、S、H2S的物质的量均为3mol,则380K时该反应的化学平衡常数为1;下列对该反应分析正确的是AB(填字母序号).

(4)在反应I中发生的化学反应为2Fe+2H2S+O2=2FeS+2H2O.
(5)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2.Na2S2O3溶液中电荷守恒式为c(Na+)+c(H+)=2c(S2O32-)+c(HS2O3-)+c(OH-);反应IV的反应类型为复分解反应;该反应不能(填“能”或“不能”)说明FeS溶解性强于FeS2O3
(6)泸天化尿塔的最终腐蚀产物为Fe2O3、FeS2O3;为了有效防腐,北钢建议泸天化在生产中用CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为Cu2++H2S=CuS↓+2H+.
分析 I.(1)原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小;非金属的非金属性越强,其氢化物越稳定、其最高价氧化物的水化物酸性越强、单质的氧化性越强等;
(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水;
II:(3)反应前后气体的体积不变,用平衡时H2、H2S的物质的量代入平衡常数表达式k=$\frac{c({H}_{2}S)}{c({H}_{2})}$计算;
A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大;
B.增大压强平衡不移动,但容器体积减小;
C.升高温度反应速率加快;
D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变;
(4)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水;
(5)由电离平衡常数可知,H2S2O3属于弱酸,Na2S2O3为强碱弱酸盐,溶液呈碱性;
阳离子带的电离等于阴离子带的电离,结合溶液中含有的离子书写;
反应Ⅳ是H2S2O3与FeS反应生成FeS2O3与H2S,反应由于生成硫化氢,不能说明FeS溶解性更强;
(6)由流程图可知,最终腐蚀产物为Fe2O3与FeS2O3;
硫化氢与硫酸铜反应生成硫化铜沉淀与硫酸.
解答 解:I.(1)原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小,所以原子半径最大的元素是C元素,其最外层电子排布式为2S22P2;
非金属的非金属性越强,其氢化物越稳定、其最高价氧化物的水化物酸性越强、单质的氧化性越强等,
A.在NO2中氧元素显负价,氮元素显正价,说明氮气的氧化性小于氧气,则O元素的非极性大于N元素,故正确;
B.H2O的热稳定性比NH3的稳定,则O元素的非金属性大于N元素,故正确;
C.常温下H2O是液态而NH3是气态不能说明O元素的非金属性大于N元素,故错误;
D.O2比N2易液化不能说明O元素的非金属性大于N元素,故错误;
故答案为:2S22P2;AB;
(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水,所以其离子方程式为:NH4++OH-=NH3.H2O=NH3↑+H2O,
故答案为:NH4++OH-=NH3.H2O=NH3↑+H2O,发生跑氨现象;
II:(3)反应前后气体的体积不变,用平衡时H2、H2S的物质的量代替浓度计算,故该反应的平衡常数k=$\frac{c({H}_{2}S)}{c({H}_{2})}$=$\frac{3mol}{3mol}$=1,
A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大,图象与实际相符合,故A正确;
B.增大压强平衡不移动,但容器体积减小,硫化氢的浓度增大,故B正确;
C.升高温度反应速率加快,图象中正反应速率不变,故C错误;
D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变,图象与实际不相符,故D错误;
故答案为:1;AB;
(4)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水,反应方程式为:2Fe+2H2S+O2=2FeS+2H2O,
故答案为:2Fe+2H2S+O2=2FeS+2H2O;
(5)由电离平衡常数可知,H2S2O3属于弱酸,Na2S2O3为强碱弱酸盐,溶液呈碱性;
阳离子带的电离等于阴离子带的电离,故c(Na+)+c(H+)=2c(S2O32-)+c(HS2O3-)+c(OH-);
反应Ⅳ是H2S2O3与FeS反应生成FeS2O3与H2S,方程式为:H2S2O3+FeS=FeS2O3+H2S↑,符合复分解反应,反应能进行由于生成硫化氢气体,不能说明FeS溶解性更强,
故答案为:碱;c(Na+)+c(H+)=2c(S2O32-)+c(HS2O3-)+c(OH-);复分解反应;不能;
(6)由流程图可知,最终腐蚀产物为Fe2O3、FeS2O3;
硫化氢与硫酸铜反应生成硫化铜沉淀与硫酸,反应离子方程式为:Cu2++H2S=CuS↓+2H+,
故答案为:Fe2O3、FeS2O3;Cu2++H2S=CuS↓+2H+.
点评 本题考查化学工艺流程、化学平衡常数、化学平衡影响因素等常用化学用语、盐类水解等,题目综合性较大,难度中等,是对学生综合能力的考查,是一道不错的能量考查题目.

Y$\underset{\stackrel{强酸}{←}}{\;}$X$\stackrel{强碱}{→}$Z.
| A. | 若X为单质铝,则Y的气体产物只能是氢气 | |
| B. | 若X为NaHCO3,则Z一定有CO2 | |
| C. | 若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3 | |
| D. | 若X为乙酸乙酯,则生成物Y、Z中均含有乙醇 |
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Ca2+、NO3- | ||
| C. | Na+、AlO2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
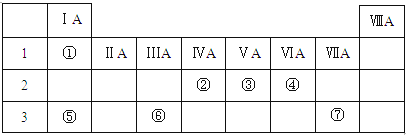
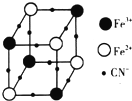 过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.
过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.

 Fe(OH)3 + 3 H+,下列操作能使FeCl3的水解程度增大且溶液的酸性增强的是( )
Fe(OH)3 + 3 H+,下列操作能使FeCl3的水解程度增大且溶液的酸性增强的是( )