题目内容
6.将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Ca2+、NO3- | ||
| C. | Na+、AlO2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
分析 离子之间不满足离子反应发生的条件-生成难溶物、弱电解质、气体、发生氧化还原反应、生成络合物等,在溶液中既能够大量共存,且通入二氧化碳后也不发生反应,
A.氢氧根离子与二氧化碳反应;
B.四种离子之间不发生反应,也不与二氧化碳反应;
C.偏铝酸根离子在溶液中与二氧化碳反应;
D.C6H5O-在溶液中与二氧化碳反应生成苯酚.
解答 解:A.OH-与二氧化碳反应,通入二氧化碳后不能够大量共存,故A错误;
B.H+、NH4+、Ca2+、NO3-离子之间不反应,通入二氧化碳后也不发生反应,在溶液中能够大量共存,故B正确;
C.AlO2-能够与二氧化碳反应,在溶液中不能够大量共存,故C错误;
D.C6H5O-能够与二氧化碳和水反应生成苯酚,在溶液中不能够大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,题目难度中等,侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-),还要明确题干暗含条件的含义.

 冲刺100分1号卷系列答案
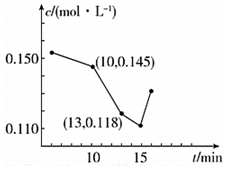
冲刺100分1号卷系列答案 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )| A. | 4 min内 v(Z)=0.025 mol•L-1•min-1 | |
| B. | Y的平衡转化率为75% | |
| C. | 平衡常数K=(25/12)(mol•L-1)-2 | |
| D. | t1 min时充入少量He,平衡向正向移动 |

| A. | 放电时,OH-向镍电极作定向移动 | |
| B. | 放电时,负极的电极反应为:H2-2e-+2OH-═2H2O | |
| C. | 充电时,将电池的碳电极与外电源的正极相连 | |
| D. | 充电时,阴极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
| A. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
| A. | 澄清的石灰水 | B. | 氯气 | C. | 浓硫酸 | D. | 氢硫酸溶液 |
| A. | 乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 | |
| B. | 乙酸具有氧化性,它能被氧化成乙醛 | |
| C. | 乙酸分子中含有碳氧双键,所以它能使溴水褪色 | |
| D. | 可利用酯化反应,分离提纯乙酸 |
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
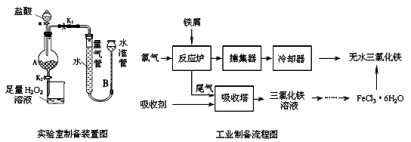
已知:(1)无水FeCl3的熔点为555K、沸点为588K。
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为。
(6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定过程中可能造成实验结果偏低的是
A.锥形瓶未润洗
B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
D.滴定终点时仰视读数
②样品中氯化铁的质量分数

 白云石的主要成份是CaCO3•MgCO3,在我国有大量的分布.以白云石为原料生产的钙镁系列产品有广泛的用途.白云石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应是放热反应,化学方程式如下:
白云石的主要成份是CaCO3•MgCO3,在我国有大量的分布.以白云石为原料生产的钙镁系列产品有广泛的用途.白云石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应是放热反应,化学方程式如下: