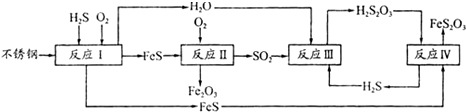
题目内容
某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。如图是制取溴苯的装置。试回答:
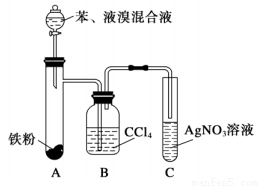
(1)装置A中发生反应的化学方程式是______________________。
(2)装置C中看到的现象是______________,证明________________。
(3)装置B是吸收瓶,内盛CCl4液体。如果没有B装置而将A、C直接相连,你认为是否妥当?__________(填“是”或“否”),理由是_____________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯_________(填“上”或“下”)层为溴苯,这说明溴苯___________且_____________。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )

| A. | 放电时,OH-向镍电极作定向移动 | |
| B. | 放电时,负极的电极反应为:H2-2e-+2OH-═2H2O | |
| C. | 充电时,将电池的碳电极与外电源的正极相连 | |
| D. | 充电时,阴极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
6.X、Y、Z、W四种元素在元素周期表中的相对位置如图所示,其中X、W的质子数和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第ⅤA族 | |
| B. | Y的一种氢化物不稳定,易分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物可与X的最高价氧化物的水化物反应 |
14.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 人造纤维、合成纤维和光导纤维都是新型无机非金属材料 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
18.下列关于乙酸性质的叙述中,正确的是( )
| A. | 乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 | |
| B. | 乙酸具有氧化性,它能被氧化成乙醛 | |
| C. | 乙酸分子中含有碳氧双键,所以它能使溴水褪色 | |
| D. | 可利用酯化反应,分离提纯乙酸 |