题目内容
7.常温下,pH=a和pH=b的两种NaOH溶液,已知b=a+2,则将两种溶液等体积混合后,所得溶液的pH接近于( )| A. | a-lg2 | B. | b-lg2 | C. | a+lg2 | D. | b+lg2 |
分析 设溶液体积都为VL,计算出两溶液中氢氧根离子的物质的量,再计算出混合液中氢氧根离子浓度,然后根据水的离子积计算出溶液中氢离子浓度,最后根据pH=-lgc(H+)计算出混合液的pH.
解答 解:设两溶液体积的体积都为VL,pH=a的氢氧化钠溶液中氢氧根离子浓度为:c(OH-)=10pH-14mol/L=10a-14mol/L,
pH=b的氢氧化钠溶液中氢氧根离子浓度为:c(OH-)=10pH-14mol/L=10b-14mol/L=10(a+2)-14mol/L=10a-12mol/L,
混合液中氢氧根离子的物质的量为:10a-14mol/L×VL+10a-12mol/L×VL(10a-14+10a-12)Vmol≈10a-12Vmol,
混合液中氢氧根离子浓度为:c(OH-)=$\frac{(1{0}^{a-14}+1{0}^{a-12})Vmol}{2VL}$=$\frac{1{0}^{a-14}+1{0}^{a-12}}{2}$mol/L≈$\frac{1{0}^{a-12}}{2}$mol/L,
混合液中氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{\frac{1{0}^{a-12}}{2}}$mol/L=2×10-a-2mol/L,
混合液的pH=-lgc(H+)=-lg2×10-a-2=a+2-lg2=b-lg2,
故选B.
点评 本题考查了溶液pH的计算,题目难度中等,明确混合碱溶液中氢离子浓度的计算为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
17.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用食醋除去热水瓶胆中的Mg(OH)2水垢:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 将少量SO2气体通往通往NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
12.同系物具有( )
①相同的通式 ②相同的物理性质 ③相似的化学性质 ④相似的结构特征 ⑤不同的分子式.
①相同的通式 ②相同的物理性质 ③相似的化学性质 ④相似的结构特征 ⑤不同的分子式.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②④⑤ |
19.月球的矿产资源极为丰富,仅月球表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[MgFeSiO4]等,下列说法或分析不正确的是( )
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
16. 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
①苯在铁作催化剂时与液溴发生取代反应,不因发生加成反应而使溴水褪色
②苯在一定条件下能与H2发生加成反应
③邻二溴苯只有一种
④苯中的碳碳键的键长均相等
⑤苯不能使酸性高锰酸钾溶液褪色.
 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( ) ①苯在铁作催化剂时与液溴发生取代反应,不因发生加成反应而使溴水褪色
②苯在一定条件下能与H2发生加成反应
③邻二溴苯只有一种
④苯中的碳碳键的键长均相等
⑤苯不能使酸性高锰酸钾溶液褪色.
| A. | ①③⑤ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④ |
14.在10L恒容密闭容器中发生反应:X(g)+Y(g)?2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是( )
| 时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.20 | 0.60 | 0 |
| 10 | a1 | a2 | 0.25 |
| 13 | b1 | 0.45 | b2 |
| 15 | d1 | d2 | 0.30 |
| A. | 前10 min内的平均反应速率v(Y)=2.5×10-3 mol/(L•min) | |
| B. | 保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10-3 mol/L | |
| C. | 若起始时只充入0.60 mol Z(g),反应达平衡时Z(g)的转化率为50% | |
| D. | 若起始时充入0.60 mol X(g)、0.10 mol Y(g)和0.50 mol Z(g),达到平衡前v(正)>v(逆) |
 炔烃
炔烃 醚
醚 酯
酯 酯
酯 醇
醇 酚
酚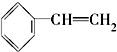 ④
④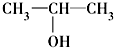 ⑤
⑤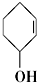 ⑥
⑥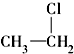 ⑦
⑦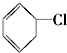 ⑧
⑧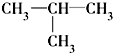 ⑨CH3-CH=CH2 (10)
⑨CH3-CH=CH2 (10)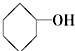 (11)
(11)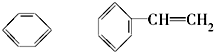 ⑫CH3Cl
⑫CH3Cl
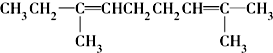 .
.