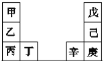
题目内容
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①该反应在常温下_______(填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是____(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=________(取小数点后两位,下同)。
②该反应的正反应为________(
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。
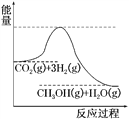
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
【答案】 不能 bd 0.13 mol·L-1·min-1 放 0.17 c d
【解析】试题分析:本题考查化学反应自发性的判断,化学平衡的标志,化学反应速率和化学平衡常数的计算,外界条件对化学平衡的影响。
(1)①该反应的ΔH![]() 0,ΔS
0,ΔS![]() 0,在常温下ΔG=ΔH-TΔS
0,在常温下ΔG=ΔH-TΔS![]() 0,该反应在常温下不能自发进行。
0,该反应在常温下不能自发进行。
②a,该容器容积可变,在建立平衡过程中容器内压强始终不变,容器中的压强不变不能说明反应达到平衡状态;b,1molH-H键断裂的同时,断裂2molH-O键,表示正逆反应速率相等,能说明反应达到平衡状态;c,根据转化之比等于化学计量数之比,c(CO)与c(H2)始终相等,c(CO)=c(H2)不能说明反应达到平衡状态;d,该反应的正反应为气体分子数增大的反应,建立平衡过程中气体分子物质的量增大,在容积可变容器中容器的容积增大,平衡时气体分子物质的量不变,容器的容积不变,容器的容积不再改变能说明反应达到平衡状态;能说明反应达到平衡状态的是bd,答案选bd。
(2)①实验1中从反应开始至平衡υ(CO)=(4mol-2.4mol)![]() 2L
2L![]() 6min=0.13mol/(L·min),则υ(CO2)=υ(CO)=0.13mol/(L·min)。
6min=0.13mol/(L·min),则υ(CO2)=υ(CO)=0.13mol/(L·min)。
②该反应反应前后气体分子数不变,根据等效平衡的规律,650℃起始向容器中充入1molH2O(g)和2molCO(起始物质的量为实验1的一半),达到平衡时H2物质的量为0.8mol、CO物质的量为1.2mol(平衡物质的量为实验1的一半);实验2为900℃起始向容器中充入1molH2O(g)和2molCO,达到平衡时H2物质的量为0.4mol、CO物质的量为1.6mol,说明升高温度平衡向逆反应方向移动,该反应的逆反应为吸热反应,正反应为放热反应。实验2条件下用三段式
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
c(起始)(mol/L) 1 0.5 0 0
c(转化)(mol/L) 0.2 0.2 0.2 0.2
c(平衡)(mol/L) 0.8 0.3 0.2 0.2
平衡常数K=![]() =
=![]() =0.17。
=0.17。
(3)a,由于反应物的总能量大于生成物的总能量,该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,c(CH3OH)减小;b,充入He(g),由于各物质的浓度不变,平衡不发生移动,c(CH3OH)不变;c,将H2O(g)从体系中分离出来,减小生成物浓度,平衡向正反应方向移动,c(CH3OH)增大;d,再充入1molCO2和3molH2,增大反应物浓度,平衡向正反应方向移动,c(CH3OH)增大;能使c(CH3OH)增大的是cd,答案选cd。

【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL (标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是______ (填字母)。
A.蒸馏水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图:
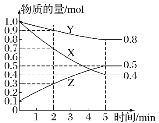
①该反应的化学方程式是______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y 的体积分数在混合气体中保持不变
B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成 1mol Y 的同时消耗 2mol Z
③2 min 内 Y 的转化率为_______。
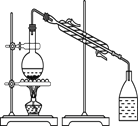
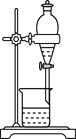
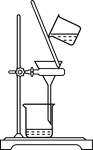
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验装置与实验目的对应的是( )
|
|
|
|
A用海水制蒸馏水 | B将碘水中的碘单质与水直接分离 | C除去Fe(OH)3胶体中的FeCl3 | D稀释浓硫酸 |
A.AB.BC.CD.D